La leishmaniasis abarca un espectro de manifestaciones clínicas causadas por la infección con el parásito protozoario intracelular Leishmania . [ 1 ] La transmisión se produce a través de la picadura de un flebótomo hembra infectado. [ 2 , 3 ]
La forma de presentación más común es la leishmaniasis cutánea, que se caracteriza por lesiones cutáneas crónicas e indoloras que van desde nódulos hasta úlceras de gran tamaño. Estas lesiones suelen persistir durante meses o años, pero finalmente se resuelven y suelen dejar cicatrices.
La leishmaniasis de las mucosas, una forma menos frecuente pero más grave, afecta las mucosas de la nariz, la boca y la garganta. Puede provocar una importante destrucción y desfiguración de los tejidos, lo que provoca graves problemas funcionales y estéticos.
La leishmaniasis visceral, la forma más grave, implica la diseminación sistémica del parásito. Las características clínicas incluyen fiebre irregular, hepatoesplenomegalia, pancitopenia e hipergammaglobulinemia policlonal. La leishmaniasis visceral no tratada conlleva una alta tasa de mortalidad.
El tratamiento de la leishmaniasis depende de la forma específica y de la gravedad de la enfermedad. Sin embargo, las opciones terapéuticas suelen ser limitadas y la resistencia a los medicamentos plantea un desafío cada vez mayor en el manejo de la enfermedad. Con excepción de Australia, las islas del Pacífico y la Antártida, los parásitos se han identificado en grandes partes del mundo.
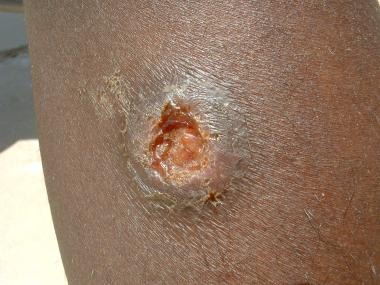 La lesión clásica de Leishmania major de un caso en Irak muestra un aspecto volcánico con bordes enrollados.
La lesión clásica de Leishmania major de un caso en Irak muestra un aspecto volcánico con bordes enrollados.Clasificación
La taxonomía de los organismos Leishmania es compleja y no existe una clasificación única que sea aceptada en general. Los dos sistemas más simples y más utilizados para clasificar la leishmaniasis son los siguientes:
Categorización por enfermedad clínica: En este sistema, la leishmaniasis se divide en 3 formas clínicas principales: cutánea (localizada, difusa (diseminada), leishmaniasis recidivante, leishmaniasis dérmica post-kala-azar), mucocutánea y visceral (kala-azar o fiebre negra en hindi) y viscerotrópica.
Categorización por ocurrencia geográfica: En este sistema, la enfermedad se divide en (1) leishmaniasis del Viejo Mundo (causada por especies de Leishmania que se encuentran en África, Asia, Medio Oriente, el Mediterráneo e India), que produce enfermedad cutánea o visceral, y (2) leishmaniasis del Nuevo Mundo (causada por especies de Leishmania que se encuentran en América Central y del Sur), que produce enfermedad cutánea, mucocutánea y visceral.
Signos y síntomas
La leishmaniasis cutánea incluye las siguientes características:
Leishmaniasis cutánea localizada: pápulas costrosas o úlceras en la piel expuesta; las lesiones pueden estar asociadas con propagación esporotricótica
Leishmaniasis cutánea difusa (diseminada): pápulas y nódulos cutáneos múltiples, generalizados, no dolorosos ni ulcerosos; análogos a las lesiones de lepra lepromatosa
Leishmaniasis recidivante: se presenta como una recurrencia de lesiones en el sitio de una enfermedad aparentemente curada años después de la infección original, típicamente en la cara y a menudo involucrando la mejilla; se manifiesta como una pápula, placa o coalescencia de pápulas que se agranda y se cura con una cicatriz central (es decir, lesiones en el centro o la periferia de una antigua cicatriz de leishmaniasis curada); la expansión implacable en la periferia puede causar una destrucción facial significativa similar a la variante de lupus vulgar de la tuberculosis cutánea
Leishmaniasis dérmica post-kala-azar: se desarrolla meses o años después de la recuperación del paciente de la leishmaniasis visceral, con lesiones cutáneas que van desde máculas hipopigmentadas hasta pápulas eritematosas y desde nódulos hasta placas; las lesiones pueden ser numerosas y persistir durante décadas.
La leishmaniasis mucocutánea consiste en la destrucción incesante de la orofaringe y la nariz, lo que provoca una destrucción extensa de la zona media de la cara. Los signos y síntomas específicos incluyen los siguientes:
Tejido excesivo que obstruye las fosas nasales, granulación septal y perforación; el cartílago nasal puede estar afectado, dando lugar a cambios externos conocidos como pico de loro o nariz de camello.
Posible presencia de granulación, erosión y ulceración del paladar, úvula, labios, faringe y laringe, con conservación de las estructuras óseas; la ronquera puede ser un signo de afectación laríngea.
Gingivitis, periodontitis
Linfadenopatía localizada
Afectación de la mucosa genital y óptica en casos graves
La leishmaniasis visceral y viscerotrópica incluye las siguientes características:
Leishmaniasis visceral (kala-azar): enfermedad sistémica generalizada potencialmente letal que se caracteriza por oscurecimiento de la piel, así como por la pentada de fiebre, pérdida de peso, hepatoesplenomegalia, pancitopenia e hipergammaglobulinemia.
Leishmaniasis viscerotrópica: Dolor abdominal inespecífico, fiebre, escalofríos, fatiga, malestar, tos no productiva, diarrea intermitente, dolor de cabeza, artralgias, mialgias, náuseas, adenopatía y hepatoesplenomegalia transitoria.
Consulte la presentación clínica para obtener más detalles.
Diagnóstico
El diagnóstico de laboratorio de la leishmaniasis puede incluir lo siguiente:
Aislamiento, visualización y cultivo del parásito a partir del tejido infectado.
Detección serológica de anticuerpos contra el antígeno recombinante K39
Ensayo de reacción en cadena de la polimerasa (PCR) para el diagnóstico rápido y sensible de especies de Leishmania
Otras pruebas que pueden considerarse incluyen las siguientes:
Hemograma completo, estudios de coagulación, pruebas de función hepática, frotis de sangre periférica
Mediciones de lipasa, amilasa, gammaglobulina y albúmina.
Prueba cutánea de leishmanina (Montenegro) (LST) (no aprobada por la FDA en los Estados Unidos)
Consulte la sección Evaluación para obtener más detalles.
Gestión
El tratamiento se adapta a cada individuo, ya que la leishmaniasis es causada por muchas especies o subespecies de Leishmania .
Las terapias farmacológicas incluyen las siguientes:
Antimonio pentavalente (estibogluconato de sodio o antimoniato de meglumina): se utiliza en la leishmaniasis cutánea; no se comercializa en los Estados Unidos, pero está disponible a través de los CDC en virtud de un protocolo de nuevo fármaco en investigación (IND)
Anfotericina B liposomal (AmBisome): eficaz contra la enfermedad mucocutánea resistente al antimonio pentavalente y la leishmaniasis visceral
Miltefosina oral (Impavido): Aprobada por la FDA en marzo de 2014 para la leishmaniasis visceral debida a L. donovani ; leishmaniasis cutánea debida a L. braziliensis, L. guyanensis y L. panamensis ; y leishmaniasis mucosa debida a L. braziliensis
Pentamidina intramuscular: eficaz contra la leishmaniasis visceral pero asociada con diabetes mellitus persistente y recurrencia de la enfermedad
Ketoconazol, itraconazol, fluconazol, alopurinol y dapsona administrados por vía oral: ninguno es tan eficaz como los compuestos de antimonio pentavalente, pero pueden ser útiles para acelerar la curación en pacientes con leishmaniasis cutánea que no progresa a enfermedad de las mucosas y tiende a resolverse por sí sola.
Paromomicina tópica: Se ha demostrado que es eficaz contra la leishmaniasis cutánea causada por L. major y L. mexicana
Sitamaquina: En fase 3 de ensayos
Las terapias locales para algunas formas de leishmaniasis cutánea incluyen las siguientes:
Crioterapia
Terapia de calor local a 40-42°C
Otros aspectos importantes en el manejo de la leishmaniasis son los siguientes:
Corrección de la desnutrición
Tratamiento de enfermedades sistémicas concurrentes (por ejemplo, enfermedad por VIH o tuberculosis)
Control de la infección local
Consulte Tratamiento y medicación para obtener más detalles.
Fondo
La leishmaniasis es una enfermedad causada por un parásito protozoario intracelular transmitido por la picadura de un flebótomo hembra ( Phlebotomus spp.). [ 1 ] El espectro clínico de la leishmaniasis varía desde una úlcera cutánea localizada que se resuelve por sí sola, hasta lesiones progresivas ampliamente diseminadas de la piel, pasando por una enfermedad mucocutánea mutilante e incluso una enfermedad sistémica letal que afecta al sistema reticuloendotelial.
 La lesión clásica de Leishmania major de un caso en Irak muestra un aspecto volcánico con bordes enrollados.
La lesión clásica de Leishmania major de un caso en Irak muestra un aspecto volcánico con bordes enrollados.Esta enfermedad afecta a 12 millones de personas en todo el mundo, con entre 900.000 y 1,3 millones de nuevos casos cada año. La incidencia mundial de la leishmaniasis ha aumentado en los últimos años debido al aumento de los viajes internacionales de ocio y de carácter militar, la alteración de los hábitats de los vectores por parte de los seres humanos y factores concomitantes que aumentan la susceptibilidad, como la infección por el virus de la inmunodeficiencia humana (VIH) y la malnutrición. Con excepción de Australia, las islas del Pacífico y la Antártida, se han identificado los parásitos en grandes partes del mundo.
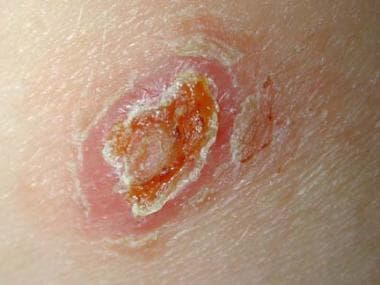 Leishmaniasis cutánea localizada del Viejo Mundo localizada en el tronco de un soldado destinado en Kuwait. Esta lesión era una ulceración no dolorosa de 3 cm por 4 cm que se desarrolló en el transcurso de 6 meses en el lugar de la picadura de un flebótomo. El paciente informó haber visto varias ratas alrededor de su campamento.
Leishmaniasis cutánea localizada del Viejo Mundo localizada en el tronco de un soldado destinado en Kuwait. Esta lesión era una ulceración no dolorosa de 3 cm por 4 cm que se desarrolló en el transcurso de 6 meses en el lugar de la picadura de un flebótomo. El paciente informó haber visto varias ratas alrededor de su campamento.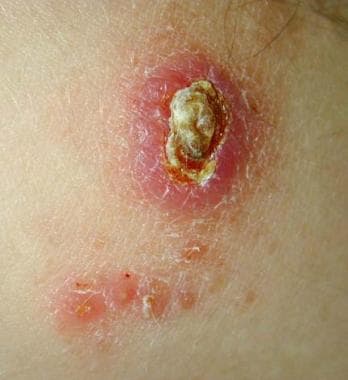 Leishmaniasis cutánea del Viejo Mundo localizada en el brazo derecho del mismo soldado destinado en Kuwait. Esta lesión de 2 cm por 3 cm estaba ubicada en la zona expuesta donde terminaba la manga. Nótense las lesiones satélite.
Leishmaniasis cutánea del Viejo Mundo localizada en el brazo derecho del mismo soldado destinado en Kuwait. Esta lesión de 2 cm por 3 cm estaba ubicada en la zona expuesta donde terminaba la manga. Nótense las lesiones satélite.La taxonomía de los organismos de Leishmania es compleja y no existe una única categorización generalmente aceptada.
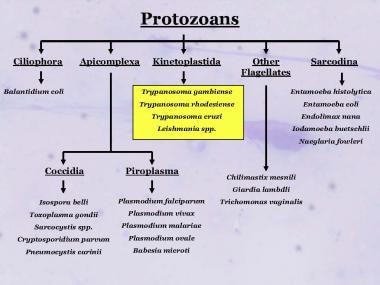 Taxonomía de algunos de los protozoos de importancia médica que muestra la relación relativa de los parásitos Kinetoplastida en general y Leishmania específicamente.
Taxonomía de algunos de los protozoos de importancia médica que muestra la relación relativa de los parásitos Kinetoplastida en general y Leishmania específicamente.Los dos sistemas de categorización de enfermedades más simples y más utilizados se basan en la enfermedad clínica y la ocurrencia geográfica, como se indica a continuación [ 2 , 3 , 1 ] :
Enfermedad clínica: Las formas clínicas primarias de leishmaniasis son la enfermedad cutánea, mucocutánea y visceral; las manifestaciones cutáneas pueden subdividirse en leishmaniasis dérmica localizada, difusa (diseminada), recidivante y post-kala-azar.
Distribución geográfica: la leishmaniasis del Viejo Mundo es causada por especies de Leishmania que se encuentran en África, Asia, Oriente Medio, el Mediterráneo y la India, y produce enfermedad cutánea o visceral; la leishmaniasis del Nuevo Mundo es causada por especies de Leishmania que se encuentran en América Central y América del Sur, y produce enfermedad cutánea, mucocutánea y visceral. El diagnóstico de la leishmaniasis suele ser difícil debido al pequeño tamaño de los protozoos secuestrados dentro de los macrófagos de la piel, la médula ósea y el sistema reticuloendotelial.
El tratamiento de las formas más graves de la enfermedad ha sido un desafío desde hace tiempo y se dificulta aún más por la aparición de resistencia a los medicamentos. No existe una vacuna eficaz contra la leishmaniasis.
Fisiopatología
Modos de transmisión
En la leishmaniasis, los protozoos intracelulares obligatorios se transmiten a los mamíferos a través de la picadura de la diminuta hembra de 2 a 3 mm de flebótomos del género Phlebotomus en el Viejo Mundo (hemisferio oriental) y Lutzomyia en el Nuevo Mundo (hemisferio occidental). [ 2 , 3 , 1 ]
La picadura de un flebótomo infectado es suficiente para provocar la enfermedad, ya que un flebótomo puede ingerir más de 1000 parásitos por picadura. Tradicionalmente divididas entre parásitos del Viejo Mundo y del Nuevo Mundo, se han identificado más de 20 especies patógenas de Leishmania [ 2 ] ; alrededor de 30 de las 500 especies conocidas de flebótomos se han identificado positivamente como vectores de la enfermedad. [ 3 ]
El flebótomo suele tener entre la mitad y un tercio del tamaño de un mosquito (véase la imagen siguiente). Las infecciones por leishmaniasis se consideran enfermedades zoonóticas, porque para la mayoría de las especies de Leishmania se requiere un reservorio animal para que persistan las condiciones endémicas. Los humanos suelen considerarse huéspedes incidentales. Las infecciones en animales salvajes no suelen ser patógenas, con la excepción de los perros, que pueden verse gravemente afectados.
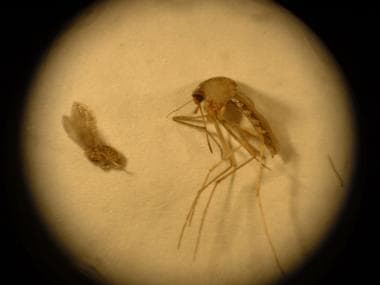 Comparación entre un flebótomo (izquierda) y un mosquito (derecha). El pequeño tamaño del flebótomo afecta la eficacia de los mosquiteros cuando se utilizan sin tratamiento con permetrina.
Comparación entre un flebótomo (izquierda) y un mosquito (derecha). El pequeño tamaño del flebótomo afecta la eficacia de los mosquiteros cuando se utilizan sin tratamiento con permetrina.Los huéspedes habituales en el Viejo Mundo son los perros domésticos y salvajes, los roedores, los zorros, los chacales, los lobos, los perros mapaches y los damanes. Los huéspedes habituales en el Nuevo Mundo son los perezosos, los osos hormigueros, las zarigüeyas y los roedores. El reservorio de infección del kala-azar indio son los humanos, mientras que en el caso del kala-azar africano son los roedores, los zorros en Brasil y Asia central y los cánidos en el caso del kala-azar mediterráneo y chino. Otros reservorios mamíferos del parásito Leishmania son los equinos y los monos.
Las formas poco comunes de transmisión incluyen la transmisión congénita, las picaduras con agujas contaminadas, las transfusiones de sangre, las relaciones sexuales y, en raras ocasiones, la inoculación de cultivos. Aunque existe una clara documentación del potencial de leishmaniasis asociada a transfusiones, hay menos certeza de que exista una documentación clara de la ocurrencia real de la enfermedad relacionada con transfusiones, porque la mayoría de los casos en la literatura ocurren en áreas endémicas del mundo. [ 4 , 5 ]
En la India, la leishmaniasis visceral causada por L. donovani no parece tener un reservorio animal y se cree que se transmite a través de la interacción entre humanos y flebótomos.
La coinfección con el virus de la inmunodeficiencia humana (VIH) ha provocado la propagación de la leishmaniasis, una enfermedad típicamente rural, a las zonas urbanas. En los pacientes infectados por el VIH, la leishmaniasis acelera la aparición del síndrome de inmunodeficiencia adquirida (SIDA) mediante la inmunodepresión acumulativa y la estimulación de la replicación del virus. También puede transformar las infecciones asintomáticas por Leishmania en infecciones sintomáticas. El uso compartido de agujas por parte de los usuarios de drogas intravenosas puede propagar no sólo el VIH sino también la leishmaniasis.
Ciclo de vida de la leishmania
Los parásitos existen en la etapa de promastigote flagelado en los flebótomos y en cultivos artificiales y luego se transforman en la forma de amastigote no flagelado en huéspedes animales y humanos.
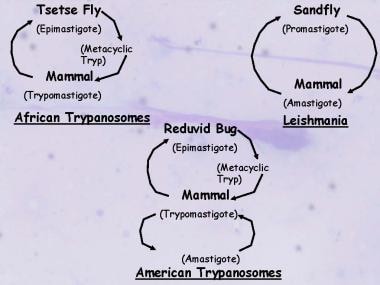 Ciclos de vida de Kinetoplastida, de importancia médica, que ilustran las similitudes y diferencias entre los tripanosomas y la Leishmania.
Ciclos de vida de Kinetoplastida, de importancia médica, que ilustran las similitudes y diferencias entre los tripanosomas y la Leishmania.Sólo la hembra del flebótomo transmite el protozoo, infectándose con los parásitos de Leishmania contenidos en la sangre que chupa de su huésped humano o mamífero. Durante 4-25 días, el parásito continúa su desarrollo dentro del flebótomo, donde sufre una importante transformación en la forma promastigote. Se produce un gran número de formas flageladas (promastigotes) por fisión binaria. La multiplicación se produce en el intestino medio del flebótomo, y los flagelados tienden a migrar a la faringe y la cavidad bucal del flebótomo. Se observa una infección faríngea grave entre los días 6 y 9 de una ingesta de sangre infectada. Los promastigotes son regurgitados a través de una picadura durante este período, lo que da lugar a la propagación de la leishmaniasis.
Tras la picadura, algunos de los flagelados que entran en la circulación del nuevo huésped son destruidos, mientras que otros entran en los orgánulos lisosomales intracelulares de los macrófagos del sistema reticuloendotelial, donde pierden sus flagelos y se transforman en amastigotes (véase la primera imagen a continuación). Las formas amastigotes también se multiplican por fisión binaria, y la multiplicación continúa hasta que la célula huésped se llena de parásitos y se rompe, liberando los amastigotes en la circulación (véase la segunda imagen a continuación). Los amastigotes libres invaden entonces nuevas células, repitiendo así el ciclo e infectando en el proceso todo el sistema reticuloendotelial. Algunos de los amastigotes libres son atraídos por el flebótomo durante su alimentación de sangre, completando así el ciclo.
 Leishmaniasis dérmica post-kala azar. Cortesía de RE Kuntz y RH Watten, Unidad de Investigación Médica Naval, Taipei, Taiwán.
Leishmaniasis dérmica post-kala azar. Cortesía de RE Kuntz y RH Watten, Unidad de Investigación Médica Naval, Taipei, Taiwán.Según la especie del parásito y el estado inmunitario del huésped, los parásitos pueden incubarse durante semanas o meses antes de presentarse como lesiones cutáneas o como una infección sistémica diseminada que afecta el hígado, el bazo y la médula ósea. La temperatura es un factor importante que ayuda a determinar la localización de las lesiones de leishmaniasis. Las especies que causan leishmaniasis visceral pueden crecer a temperaturas centrales, mientras que las responsables de la leishmaniasis cutánea crecen mejor a temperaturas más bajas. La patogenia parece estar relacionada con la citotoxicidad de las células T.
La leishmaniasis cutánea es causada por L. tropica ; no se ha identificado un reservorio animal para la leishmaniasis causada por este organismo, aunque se ha encontrado en algunos perros en áreas endémicas. Morfológicamente, es indistinguible de L. donovani . El ciclo de vida es exactamente el mismo que el de L. donovani, excepto que la forma amastigote reside en las células mononucleares grandes de la piel.
Patogenesia
Tras la inoculación por flebótomos, los promastigotes flagelados se unen a los macrófagos de la piel. Dos de las moléculas de la superficie del parásito parecen desempeñar un papel destacado en las interacciones entre el parásito y el fagocito. La extensión y la presentación de la enfermedad dependen de varios factores, entre ellos la respuesta inmunitaria humoral y celular del huésped, la virulencia de la especie infectante y la carga parasitaria. Las infecciones pueden curarse espontáneamente o pueden progresar a una enfermedad crónica, que a menudo resulta en la muerte por infección secundaria.
Los promastigotes activan el complemento a través de la vía alterna y se opsonizan. La característica inmunológica más importante es una marcada supresión de la inmunidad celular a los antígenos de la leishmaniasis. En las personas con infección asintomática que se resuelve por sí sola, predominan las células T colaboradoras (Th1), siendo la interleucina 2 (IL-2), el interferón gamma y la IL-12 las citocinas principales que inducen la resolución de la enfermedad, aunque la supresión inmunitaria años después puede provocar la enfermedad. También se produce una sobreproducción tanto de inmunoglobulinas específicas como de inmunoglobulinas no específicas. El aumento de la gammaglobulina conduce a una inversión de la relación albúmina-globulina que se asocia habitualmente a esta enfermedad.
Como se ha señalado anteriormente, la leishmaniasis afecta al sistema reticuloendotelial. Los macrófagos parasitados diseminan la infección a todas las partes del cuerpo, pero más al bazo, el hígado y la médula ósea. El bazo está agrandado, con un engrosamiento de la cápsula, y es blando y frágil; sus espacios vasculares están dilatados y congestionados de sangre. Las células reticulares de Billroth están marcadamente aumentadas y repletas de las formas amastigotes del parásito. Sin embargo, no hay evidencia de fibrosis. En el hígado, las células de Kupffer están aumentadas de tamaño y número e infectadas con formas amastigotes de Leishmania. La médula ósea se vuelve hiperplásica y los macrófagos parasitados reemplazan el tejido hematopoyético normal.
En la enfermedad cutánea visceral o difusa (diseminada), los pacientes presentan una anergia relativa al organismo Leishmania y tienen un perfil de citocinas Th2 prominente. Por lo general, la leishmaniasis visceral se incuba durante semanas o meses antes de manifestarse clínicamente. La enfermedad puede ser subaguda, aguda o crónica y puede manifestarse en pacientes inmunodeprimidos años después de haber abandonado las regiones endémicas.
Además, se han encontrado genes de susceptibilidad en la banda 22q12 en un grupo étnico en partes de Sudán que tiene una alta tasa de prevalencia de leishmaniasis visceral.
Etiología
Factores de riesgo
La pobreza y la malnutrición desempeñan un papel importante en la mayor susceptibilidad a la leishmaniasis. [ 2 , 3 , 1 ] La extracción de madera, la minería, la construcción de presas, la ampliación de las zonas de cultivo, la creación de nuevos sistemas de irrigación, la expansión de la construcción de carreteras en bosques primarios como el Amazonas, la continua migración generalizada de las zonas rurales a las urbanas y la continua y rápida urbanización en todo el mundo se encuentran entre las principales causas de la mayor exposición a los flebótomos.
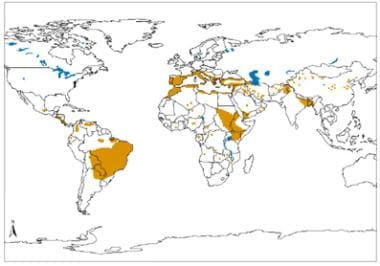 Distribución geográfica de la leishmaniasis visceral en el Viejo y el Nuevo Mundo. Fuente: Organización Mundial de la Salud, Departamento de Control de las Enfermedades Tropicales Desatendidas, Gestión Innovadora e Intensificada de Enfermedades (WHO/NTD/IDM) Virus de inmunodeficiencia humana/síndrome de inmunodeficiencia adquirida (VIH/SIDA), tuberculosis y malaria (HTM) OMS, octubre de 2010: https://www.who.int/leishmaniasis/leishmaniasis_maps/en/.
Distribución geográfica de la leishmaniasis visceral en el Viejo y el Nuevo Mundo. Fuente: Organización Mundial de la Salud, Departamento de Control de las Enfermedades Tropicales Desatendidas, Gestión Innovadora e Intensificada de Enfermedades (WHO/NTD/IDM) Virus de inmunodeficiencia humana/síndrome de inmunodeficiencia adquirida (VIH/SIDA), tuberculosis y malaria (HTM) OMS, octubre de 2010: https://www.who.int/leishmaniasis/leishmaniasis_maps/en/.Otro factor de riesgo es el desplazamiento de poblaciones susceptibles a zonas endémicas, incluida la migración en gran escala de poblaciones por razones económicas. En la ciudad de Kabul (Afganistán), con una población de menos de dos millones de habitantes, se estima que en 1996 se produjeron 270.000 casos de leishmaniasis cutánea. El resurgimiento de la leishmaniasis visceral se ha debido a deficiencias en el control del vector (flebótomo), la ausencia de una vacuna y la falta de acceso al tratamiento médico debido a su coste y a la creciente resistencia a los fármacos de primera línea.
La coexistencia de la leishmaniasis con la infección por el virus de la inmunodeficiencia humana (VIH) es un problema grave. La leishmaniasis se está extendiendo en varias zonas del mundo debido a la rápida propagación de la epidemia del síndrome de inmunodeficiencia adquirida (SIDA). La deficiencia inmunitaria ha aumentado la susceptibilidad a las infecciones, incluida la leishmaniasis: las personas con SIDA tienen un riesgo entre 100 y 1.000 veces mayor de desarrollar leishmaniasis visceral en determinadas zonas. Hasta el momento, se han notificado casos de coinfección en 33 países de todo el mundo.
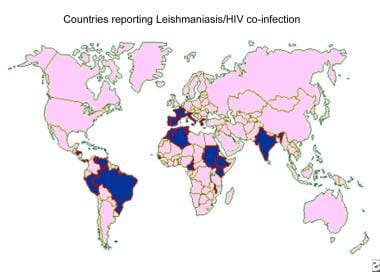 Mapa de distribución de la coinfección por el virus de la inmunodeficiencia humana (VIH) y leishmaniasis.
Mapa de distribución de la coinfección por el virus de la inmunodeficiencia humana (VIH) y leishmaniasis.Los niños corren un riesgo mayor que los adultos en las zonas endémicas. El tratamiento incompleto de la enfermedad inicial es un factor de riesgo de recurrencia.
A continuación se resumen las especies de parásitos comúnmente asociadas y su distribución geográfica.
Distribución de la leishmaniasis cutánea
La propagación de la enfermedad cutánea localizada en el Viejo Mundo incluye las siguientes especies de Leishmania :
L donovani - China, India, Bangladesh, Sudán
L tropica - Medio Oriente, China, India, Mediterráneo
L aethiopica - Etiopía, Kenia, Namibia
La mayor : Oriente Medio, África, India, Asia
L infantum - Asia, África, Europa
La leishmaniasis cutánea difusa se propaga en el Viejo Mundo a través de L. aethiopica en Etiopía, Kenia y Namibia.
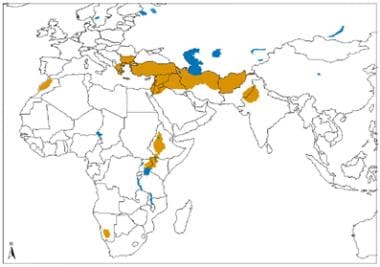 Distribución geográfica de la leishmaniasis cutánea del Viejo Mundo causada por L. tropica y especies relacionadas y L. aethiopica. Fuente: Organización Mundial de la Salud, Departamento de Control de las Enfermedades Tropicales Desatendidas, Gestión Innovadora e Intensificada de Enfermedades (WHO/NTD/IDM) Virus de inmunodeficiencia humana/síndrome de inmunodeficiencia adquirida (VIH/SIDA), tuberculosis y malaria (HTM) OMS, octubre de 2010: https://www.who.int/leishmaniasis/leishmaniasis_maps/en/index1.html
Distribución geográfica de la leishmaniasis cutánea del Viejo Mundo causada por L. tropica y especies relacionadas y L. aethiopica. Fuente: Organización Mundial de la Salud, Departamento de Control de las Enfermedades Tropicales Desatendidas, Gestión Innovadora e Intensificada de Enfermedades (WHO/NTD/IDM) Virus de inmunodeficiencia humana/síndrome de inmunodeficiencia adquirida (VIH/SIDA), tuberculosis y malaria (HTM) OMS, octubre de 2010: https://www.who.int/leishmaniasis/leishmaniasis_maps/en/index1.html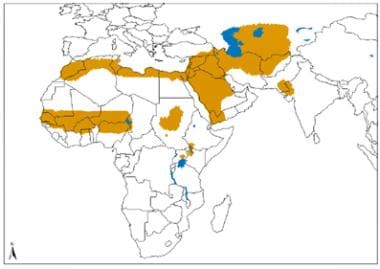 Distribución geográfica de la leishmaniasis cutánea del Viejo Mundo debida a L. major. Fuente: Organización Mundial de la Salud, Departamento de Control de las Enfermedades Tropicales Desatendidas, Gestión Innovadora e Intensificada de Enfermedades (WHO/NTD/IDM) Virus de inmunodeficiencia humana/síndrome de inmunodeficiencia adquirida (VIH/SIDA), tuberculosis y malaria (HTM) OMS, octubre de 2010: https://www.who.int/leishmaniasis/leishmaniasis_maps/en/index1.html.
Distribución geográfica de la leishmaniasis cutánea del Viejo Mundo debida a L. major. Fuente: Organización Mundial de la Salud, Departamento de Control de las Enfermedades Tropicales Desatendidas, Gestión Innovadora e Intensificada de Enfermedades (WHO/NTD/IDM) Virus de inmunodeficiencia humana/síndrome de inmunodeficiencia adquirida (VIH/SIDA), tuberculosis y malaria (HTM) OMS, octubre de 2010: https://www.who.int/leishmaniasis/leishmaniasis_maps/en/index1.html.La propagación en el Nuevo Mundo de la enfermedad cutánea localizada incluye las siguientes especies de Leishmania :
L. mexicana - América Central, del Sur y del Norte
L amazonensis - República Dominicana, Centro y Sudamérica
L. venezuelensis - Venezuela
L (Viannia) braziliensis - América Central y del Sur
L (Viannia) guyanensis - Guyana, Guyana Francesa, Surinam, Brasil
L (Viannia) panamensis - Costa Rica, Panamá, Colombia, Ecuador
L (Viannia) peruviana - Perú, Argentina
L donovani chagasi - Texas, Caribe, América Central y del Sur
La propagación en el Nuevo Mundo de la leishmaniasis cutánea difusa se produce a través de (1) L. mexicana en América Central, del Sur y del Norte, (2) L. amazonensis en República Dominicana y América Central y del Sur, y (3) L. venezuelensis en Venezuela.
Leishmaniasis recidivante
La leishmaniasis recidivante, una variante clínica relativamente poco común de la leishmaniasis, aparece como una recurrencia de lesiones en el sitio de una enfermedad aparentemente curada años después de la infección original.
La leishmaniasis recidivante se propaga en el Viejo Mundo a través de L. tropica en Oriente Medio, China, India y el Mediterráneo. La leishmaniasis recidivante se propaga en el Nuevo Mundo a través de L. (Viannia) braziliensis en América Central y del Sur.
Leishmaniasis post-kala-azar
El término kala-azar, que significa fiebre negra (kala) (azar) en hindi, se reserva para casos graves (avanzados) de leishmaniasis visceral, aunque a veces los términos kala-azar y leishmaniasis visceral se usan indistintamente. [ 3 ]
La leishmaniasis dérmica post-kala-azar (PKDL) es un síndrome caracterizado por lesiones cutáneas que se desarrollan a intervalos variables después (o durante) del tratamiento de la leishmaniasis visceral. [ 3 ] Esta afección se describe mejor en casos de infección por L. donovani en el sur de Asia y el este de África. En general, la leishmaniasis dérmica post-kala-azar es más común, se desarrolla antes y es menos crónica en pacientes del este de África. [ 3 ]
La propagación de la leishmaniasis post-kala-azar en el Viejo Mundo se produce a través de las siguientes vías:
L donovani - China, India y Bangladesh
L infantum - Asia, África y Europa
La propagación en el Nuevo Mundo de la leishmaniasis post–kala–azar se produce a través de L. donovani chagasi en América Central y del Sur.
Distribución de la leishmaniasis mucocutánea
La leishmaniasis mucocutánea se propaga en el Viejo Mundo a través de L. aethiopica en Etiopía, Kenia y Namibia.
La propagación en el Nuevo Mundo de la leishmaniasis mucocutánea incluye las siguientes especies de Leishmania :
L (Viannia) braziliensis - América Central y del Sur
L (Viannia) panamensis - América Central y del Sur
L (Viannia) guyanensis - Guyana, Guyana Francesa, Surinam y Brasil
Se observa con menos frecuencia con L mexicana : América Central, del Sur y del Norte.
Se observa con menos frecuencia con L amazonensis - Brasil y Panamá
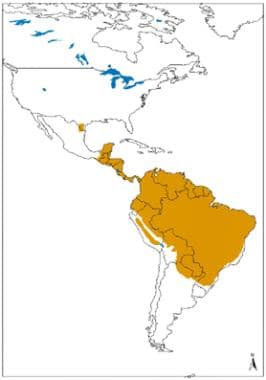 Distribución geográfica de la leishmaniasis cutánea y mucocutánea en el Nuevo Mundo. Fuente: Organización Mundial de la Salud, Departamento de Control de las Enfermedades Tropicales Desatendidas, Gestión Innovadora e Intensificada de Enfermedades (WHO/NTD/IDM) Virus de Inmunodeficiencia Humana/Síndrome de Inmunodeficiencia Adquirida (VIH/SIDA), Tuberculosis y Malaria (HTM) OMS, octubre de 2010: https://www.who.int/leishmaniasis/leishmaniasis_maps/en/
Distribución geográfica de la leishmaniasis cutánea y mucocutánea en el Nuevo Mundo. Fuente: Organización Mundial de la Salud, Departamento de Control de las Enfermedades Tropicales Desatendidas, Gestión Innovadora e Intensificada de Enfermedades (WHO/NTD/IDM) Virus de Inmunodeficiencia Humana/Síndrome de Inmunodeficiencia Adquirida (VIH/SIDA), Tuberculosis y Malaria (HTM) OMS, octubre de 2010: https://www.who.int/leishmaniasis/leishmaniasis_maps/en/
Distribución de la leishmaniasis visceral
La propagación de la leishmaniasis visceral en el Viejo Mundo se produce a través de las siguientes vías:
L donovani : China, India, Bangladesh, Sudán y Kenia
L infantum - Asia, norte de África y sur de Europa
(Rara vez) L tropica - Irán y Kenia
La propagación mundial de la leishmaniasis visceral se produce a través de L. donovani chagasi en América Central y del Sur.
Distribución de la leishmaniasis viscerotrópica
La propagación de la leishmaniasis viscerotrópica en el Viejo Mundo se produce a través de L. tropica en Oriente Medio.
Epidemiología
Estadísticas de Estados Unidos
La leishmaniasis endémica es poco común en los Estados Unidos. [ 2 , 3 , 1 ] Aunque los flebótomos se encuentran tan al norte como el estado de Nueva York, y se ha identificado leishmaniasis visceral en perros de caza en una amplia distribución geográfica en los Estados Unidos, prácticamente no se cree que haya transmisión humana en la mayoría de los Estados Unidos.
Se han descrito casos periódicos y aislados de leishmaniasis cutánea localizada y difusa en zonas fronterizas con México, como el sur de Texas, Oklahoma [ 3 , 6 ] y Pensilvania, sin viajes asociados fuera del domicilio del paciente. El reservorio habitual es la rata de bosque de las llanuras del sur, pero se han identificado parásitos en coyotes y perros y gatos domésticos. Los casos de leishmaniasis, que se transmiten por el vector flebótomo Lutzomyia anthophora , suelen estar asociados a la exposición al hábitat de la rata de bosque.
A finales de 2009 se describieron dos casos de leishmaniasis cutánea causada por L. mexicana y ninguno después de ese año. Según el Repositorio de Datos del Observatorio Mundial de la Salud de la OMS, no se han notificado nuevos casos de leishmaniasis visceral desde 2005.
La mayoría de los casos de leishmaniasis detectados en Estados Unidos se contraen en otros países: viajeros estadounidenses, empleados del gobierno, estudiantes de posgrado, trabajadores del Cuerpo de Paz y personal militar corren riesgo en el extranjero. Entre 1985 y 1990, los Centros para el Control y la Prevención de Enfermedades (CDC) recibieron notificaciones de 129 casos de viajeros procedentes de Estados Unidos que contrajeron la enfermedad en el extranjero.
Durante la Segunda Guerra Mundial, se registraron más de 1000 casos de leishmaniasis cutánea entre militares estadounidenses que prestaban servicio en el Golfo Pérsico. Se han identificado enfermedades atribuidas a la leishmaniasis en campañas militares desde la Primera Guerra Mundial hasta la antigüedad.
Durante la primera Guerra del Golfo Pérsico, se notificaron aproximadamente 400 casos de leishmaniasis cutánea y 12 casos de leishmaniasis viscerotrópica. [ 7 ] El agente etiológico de la mayoría de los casos de leishmaniasis cutánea parece haber sido L. major . Desde 2001, más de 700 militares estadounidenses han sido diagnosticados con leishmaniasis cutánea y 4 con leishmaniasis visceral después de servir en Afganistán y Oriente Medio.
Los conflictos en Irak y Afganistán dieron lugar a aproximadamente 2000 casos confirmados en laboratorio (y al menos el doble de casos no confirmados) de leishmaniasis cutánea y 5 casos confirmados en laboratorio de leishmaniasis visceral en soldados estadounidenses solamente entre 2003 y 2008. [ 8 , 9 ] Se diagnosticaron más de 500 casos de leishmaniasis durante un período de 18 meses en soldados que regresaron a los Estados Unidos desde Oriente Medio, especialmente desde Irak. Una gran parte de estos casos se identificaron como leishmaniasis cutánea. Es posible que hasta el 1% de las fuerzas estadounidenses que prestan servicio en el teatro de operaciones del sudoeste asiático hayan resultado infectadas. [ 10 ]
Estadísticas internacionales
La distribución geográfica de la leishmaniasis generalmente está restringida a las regiones tropicales y templadas (hábitats naturales del flebótomo) y está limitada por la susceptibilidad del flebótomo a los climas fríos, su tendencia a tomar sangre de humanos o animales solamente y su capacidad para apoyar el desarrollo interno de especies específicas de Leishmania . [ 2 , 1 ] Con el aumento de los viajes internacionales, la inmigración, los ejercicios militares en el extranjero y la coinfección con el virus de la inmunodeficiencia humana (VIH), la leishmaniasis se está volviendo más frecuente en todo el mundo.
La Organización Mundial de la Salud (OMS) informa de leishmaniasis endémica en 98 países y 3 territorios en 5 continentes (África, Asia, Europa, América del Norte, América del Sur), con una incidencia anual estimada oficial de 0,7-1,3 millones de casos de enfermedad cutánea y de 0,2-0,4 millones de casos de enfermedad visceral. [ 2 ]
Aproximadamente el 95% de los casos de enfermedad cutánea se producen en las Américas, la cuenca mediterránea, Oriente Medio y Asia central. Más de dos tercios de estos casos se notifican en seis países, entre ellos Afganistán, Argelia, Brasil, Colombia, Irán y Siria. Más del 90% de los nuevos casos de leishmaniasis visceral se producen en seis países: Bangladesh, Brasil, Etiopía, India, Sudán del Sur y Sudán. [ 2 ] La India tiene la mayor carga de leishmaniasis visceral, con 13.869 nuevos casos notificados en 2013. [ 11 ]
El programa de control de la leishmaniasis visceral ha logrado avances significativos en el Sudeste Asiático, con una incidencia que se redujo a 10.209 casos en 2014, aproximadamente un 75% menos que en 2005, cuando se puso en marcha el programa de control de Kala-Azar. En esta región, la enfermedad está a punto de ser eliminada de la lista de problemas de salud pública. [ 12 ]
Casi el 90% de los casos de leishmaniasis mucocutánea ocurren en Bolivia, Brasil y Perú. [ 2 ]
En Colombia, los militares que luchan contra las Fuerzas Armadas Revolucionarias de Colombia (FARC) detectaron más de 30.000 casos de leishmaniasis en un período de tres años.
Países y/o regiones que no se consideran con leishmaniasis endémica a pesar de estar rodeados por regiones que sí la tienen incluyen Australia y el Pacífico Sur, Chile, Uruguay y Canadá.
La leishmaniasis visceral y cutánea en pacientes con SIDA se ha reconocido cada vez más como una posible infección oportunista. Se ha informado de coinfección con VIH en más de 35 países de Europa meridional, la cuenca mediterránea, América Central y del Sur y la India. [ 13 ] La enfermedad se presenta junto con una inmunosupresión grave. La incidencia de coinfección ha disminuido en los países desarrollados debido al uso generalizado de la terapia antirretroviral.
Diferencias raciales, sexuales y relacionadas con la edad en la incidencia
Aunque no se reconocen ni describen preferencias raciales para la leishmaniasis, se han observado algunas asociaciones menores con varios grupos raciales. [ 2 , 3 , 1 ] Sin embargo, esos datos se ven confundidos y resultan más fuertemente asociados con la exposición ocupacional .
Los hombres tienen una mayor incidencia de infección, aproximadamente el doble que las mujeres. Las tasas más altas de infección en los hombres, en particular de leishmaniasis visceral, pueden deberse a una mayor exposición ambiental al hábitat del flebótomo a través del trabajo y la actividad de ocio.
La leishmaniasis afecta a distintos grupos de edad, según la especie infectante, la ubicación geográfica, el reservorio de la enfermedad y la inmunocompetencia del huésped. Las personas en los extremos de edad pueden ser menos capaces de generar respuestas inmunitarias eficaces a la infección y, por lo tanto, manifestar la enfermedad clínica con mayor frecuencia, especialmente en asociación con la leishmaniasis visceral.
La leishmaniasis cutánea afecta a todos los grupos de edad. Los informes de Afganistán y Colombia muestran que los adolescentes y los adultos jóvenes son los que corren mayor riesgo. En Irán, la mayoría de los casos de la enfermedad se dan en lactantes.
La leishmaniasis visceral se presenta en todos los grupos de edad en la India y Brasil, donde no se ha identificado un reservorio animal. En áreas con reservorios animales conocidos, como la cuenca mediterránea, la leishmaniasis visceral afecta principalmente a los niños, con resultados devastadores (p. ej., L. infantum afecta principalmente a niños de 1 a 4 años). Esta aparente predilección por los jóvenes parece ocurrir en áreas altamente endémicas debido a lo que puede ser una inmunidad protectora que reduce el riesgo de reinfección en adultos. La leishmaniasis visceral no tratada en una persona embarazada también puede tener consecuencias en el feto o resultar en leishmaniasis visceral congénita.
Pronóstico
En general, el pronóstico depende del estado nutricional e inmunológico general del huésped, la especie precisa de infección y la terapia adecuada. [ 2 , 3 , 1 ]
Leishmaniasis cutánea
La leishmaniasis cutánea localizada suele resolverse espontáneamente en 3-6 meses sin tratamiento, aunque algunas infecciones persisten indefinidamente. La mayoría de las personas responden muy bien al tratamiento: la resolución rápida y completa de la lesión o lesiones, con menor posibilidad de infecciones bacterianas secundarias y menor formación de cicatrices, es la norma. Esto no quiere decir que la enfermedad no presente morbilidad, especialmente en zonas donde incluso una mínima desfiguración facial puede condenar a las jóvenes a una vida sin perspectivas de matrimonio o aceptación en la sociedad.
La mayoría de los casos de leishmaniasis cutánea difusa, leishmaniasis dérmica post-kala-azar y leishmaniasis recidivante son crónicos y resistentes al tratamiento. Estas formas pueden ser sumamente desfigurantes desde el punto de vista cosmético debido al grado de afectación persistente; sin embargo, se asocian con bajas tasas de mortalidad.
Leishmaniasis mucocutánea
La leishmaniasis mucocutánea es crónica y progresiva. Esta forma de la enfermedad afecta las mucosas de la boca, la nariz y el paladar blando, y es especialmente debilitante y destructiva, provocando una mutilación extensa de la región media de la cara. La muerte puede sobrevenir por una infección secundaria y tras la invasión de la mucosa de las vías respiratorias. El compromiso respiratorio y la disfagia pueden provocar desnutrición y neumonía.
El consenso general es que menos del 5% de los individuos infectados por L. brasiliensis, y un porcentaje menor de individuos infectados por L. panamensis y L. guyanensis, desarrollan metástasis mucosas varios meses o años después de la aparente resolución de la enfermedad cutánea. Sin embargo, ningún estudio riguroso prueba esta tasa comúnmente aceptada.
Leishmaniasis visceral
La leishmaniasis visceral es una enfermedad sistémica grave, progresiva y potencialmente letal. Suele afectar a personas con mal estado de salud, con un estado nutricional deficiente e incluso con un estado inmunitario mínimamente disminuido, de forma mucho más grave que a personas con buena salud, buen estado nutricional y sistemas inmunitarios intactos.
En individuos bien nutridos con sistemas inmunológicos intactos, se espera una recuperación completa de la enfermedad visceral después del tratamiento con la medicación adecuada. Con terapia temprana y cuidados de apoyo, la mortalidad en pacientes con enfermedad visceral se reduce a aproximadamente el 5%; sin terapia, la mayoría de los pacientes con enfermedad visceral (kala-azar) (75-95%) mueren dentro de los 2 años, a menudo por desnutrición e infección secundaria, como neumonía bacteriana, septicemia, disentería, tuberculosis, cáncer de boca y hemorragia no controlada o sus secuelas.
En algunas regiones endémicas, la resistencia al antimonial pentavalente está provocando un aumento de las tasas de mortalidad.
Complicaciones
Las complicaciones de la leishmaniasis se producen como consecuencia de anemia, leucopenia y trombocitopenia. Pueden ser las siguientes:
Infección bacteriana secundaria, incluida neumonía y tuberculosis.
Septicemia
Desfiguración de la nariz, los labios y el paladar (p. ej., cáncer de la boca)
Sangrado incontrolado
Ruptura esplénica
Etapas tardías: edema, caquexia e hiperpigmentación.
Lesiones metastásicas en la nasofaringe con destrucción tisular.
La coinfección con el virus de la inmunodeficiencia humana (VIH) puede complicar los casos de leishmaniasis visceral. Una interacción bien descrita y temida es la del kala-azar en combinación con la infección por VIH, que conduce a desenlaces fatales más graves y de progresión rápida debido a que ambas enfermedades actúan de manera sinérgica.
Educación del paciente
La modificación del comportamiento para evitar el contacto con el vector, combinada con medidas de control de insectos, disminuye significativamente el riesgo de contraer la infección. [ 2 , 3 , 1 ]
Educar a los pacientes sobre (1) la posibilidad de recurrencia de la enfermedad e indicarles que programen controles según sea necesario; (2) la transmisión de la leishmaniasis; y (3) los factores de riesgo de la leishmaniasis, incluidos los siguientes:
Exposición al hábitat de los flebótomos
Edad (dependiendo de la especie infectante y del área geográfica)
Sexo masculino
Adultos inmunológicamente ingenuos que ingresan a un área endémica
Pacientes inmunodeprimidos (por ejemplo, receptores de trasplantes, usuarios crónicos de esteroides, personas con enfermedades malignas)
Desnutrición
Infección por el virus de la inmunodeficiencia humana (VIH) y síndrome de inmunodeficiencia adquirida (SIDA)
Uso de drogas intravenosas en zonas endémicas
Historia
Aunque las especies de Leishmania difieren clínica y biológicamente, sus características se superponen y cada síndrome clínico puede ser producido por múltiples especies de Leishmania . [ 2 , 3 , 1 ]
Leishmaniasis cutánea
El amplio espectro de manifestaciones clínicas de la leishmaniasis cutánea se compara a menudo con el de la lepra. La leishmaniasis cutánea puede ser simple o difusa (diseminada). Las diferentes especies, así como los factores del huésped, también pueden afectar al cuadro clínico, en el que algunas especies causan úlceras "húmedas" y otras, úlceras "secas".
La característica distintiva de la leishmaniasis cutánea son las lesiones cutáneas, que pueden curarse espontáneamente en un plazo de entre 2 y 10 meses. La inoculación se produce después de que un flebótomo pica una parte expuesta del cuerpo (normalmente las piernas, los brazos, el cuello o la cara). La incubación dura semanas o meses, seguida de la aparición de una pápula eritematosa, que puede evolucionar hasta convertirse en una placa o una úlcera. Estas lesiones suelen ser indoloras.
No se evidencian síntomas sistémicos. Después de la recuperación o del tratamiento exitoso, la leishmaniasis cutánea induce inmunidad a la reinfección por la especie de Leishmania que causó la enfermedad.
Enfermedad cutánea localizada
Tanto las especies del Nuevo Mundo como las del Viejo Mundo causan leishmaniasis cutánea localizada. La enfermedad del Nuevo Mundo suele presentarse con un nódulo solitario, mientras que la enfermedad del Viejo Mundo se asocia con múltiples lesiones. No hay síntomas sistémicos. La herida progresa con el tiempo y puede presentar diseminación linfangítica localizada.
 Leishmaniasis cutánea localizada del Viejo Mundo localizada en el tronco de un soldado destinado en Kuwait. Esta lesión era una ulceración no dolorosa de 3 cm por 4 cm que se desarrolló en el transcurso de 6 meses en el lugar de la picadura de un flebótomo. El paciente informó haber visto varias ratas alrededor de su campamento.
Leishmaniasis cutánea localizada del Viejo Mundo localizada en el tronco de un soldado destinado en Kuwait. Esta lesión era una ulceración no dolorosa de 3 cm por 4 cm que se desarrolló en el transcurso de 6 meses en el lugar de la picadura de un flebótomo. El paciente informó haber visto varias ratas alrededor de su campamento. Leishmaniasis cutánea del Viejo Mundo localizada en el brazo derecho del mismo soldado destinado en Kuwait. Esta lesión de 2 cm por 3 cm estaba ubicada en la zona expuesta donde terminaba la manga. Nótense las lesiones satélite.
Leishmaniasis cutánea del Viejo Mundo localizada en el brazo derecho del mismo soldado destinado en Kuwait. Esta lesión de 2 cm por 3 cm estaba ubicada en la zona expuesta donde terminaba la manga. Nótense las lesiones satélite.Las lesiones suelen ser asintomáticas y no producen prurito, aunque la herida puede verse complicada por una infección bacteriana secundaria (véase la siguiente imagen). La curación puede producirse de forma espontánea en un plazo de entre 2 y 12 meses, seguida de cicatrización y cambios en la pigmentación. La enfermedad del Nuevo Mundo puede evolucionar a leishmaniasis mucocutánea.
Leishmaniasis cutánea difusa
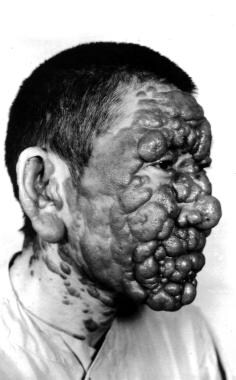
La enfermedad cutánea difusa se desarrolla en un huésped anérgico con una respuesta inmunitaria deficiente. Esta afección se asocia a una inmunidad celular deficiente que permite que el parásito se disemine en los tejidos subcutáneos y se ha descrito en pacientes con infección por el virus de la inmunodeficiencia humana (VIH) .
La infección se caracteriza por una lesión primaria que se extiende lentamente hasta afectar varias zonas de la piel (cara, orejas, extremidades, nalgas) hasta afectar todo el cuerpo. Pueden formarse placas, úlceras y nódulos en todo el cuerpo, similares a la lepra lepromatosa (véase la imagen siguiente). Sin embargo, no se produce invasión neurológica ni sistémica; por lo tanto, aunque las lesiones no son ni destructivas ni erosivas, sí causan desfiguración. Las infecciones son crónicas y pueden volver a aparecer después del tratamiento.
Aunque la enfermedad difusa es más común en las especies del Nuevo Mundo en América Central y del Sur, la L. aethiopica del Viejo Mundo puede progresar a enfermedad difusa en África Oriental.
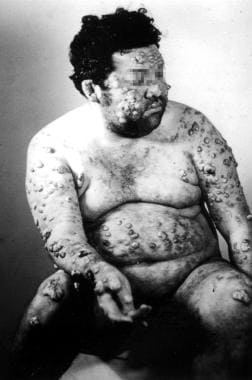 Leishmaniasis cutánea difusa (diseminada). Cortesía de Jacinto Convit, Instituto Nacional de Dermatología de Caracas, Venezuela.
Leishmaniasis cutánea difusa (diseminada). Cortesía de Jacinto Convit, Instituto Nacional de Dermatología de Caracas, Venezuela.Leishmaniasis recidivante
La leishmaniasis recidivante puede aparecer años después de que se haya curado una lesión cutánea localizada, y suele presentarse en la cara (véase la siguiente imagen). Se forman nuevas úlceras y pápulas sobre el borde de la cicatriz anterior y avanzan hacia el interior para formar una lesión psoriasiforme. La infección puede deberse a la reactivación de parásitos latentes o a una nueva infección de una especie diferente. El traumatismo cutáneo puede provocar la activación de una infección cutánea aparentemente latente mucho después de la picadura inicial. Las infecciones tienden a ser resistentes al tratamiento.
Leishmaniasis dérmica post-kala azar
La leishmaniasis dérmica post-kala-azar sigue al tratamiento de la leishmaniasis visceral y se ha descrito predominantemente en África (alrededor del 2% de los casos) y la India (alrededor del 10% de los casos).
La variante india se presenta en pacientes entre 1 y 2 años y hasta 20 años después de la recuperación de la leishmaniasis visceral. Esta afección se caracteriza por múltiples máculas eritematosas hipopigmentadas. Con el tiempo, estas máculas pueden transformarse en grandes placas y nódulos indoloros que afectan la cara y el tronco (ver la imagen a continuación). La enfermedad se parece a la lepra lepromatosa y requiere terapia intensiva. La variante africana se presenta poco después del tratamiento de la leishmaniasis visceral y se caracteriza por una erupción papulosa eritematosa en la cara, las nalgas y las extremidades. Estas lesiones se resuelven espontáneamente en el transcurso de varios meses.
 Leishmaniasis dérmica post-kala azar. Cortesía de RE Kuntz y RH Watten, Unidad de Investigación Médica Naval, Taipei, Taiwán.
Leishmaniasis dérmica post-kala azar. Cortesía de RE Kuntz y RH Watten, Unidad de Investigación Médica Naval, Taipei, Taiwán.En Sudán, los pacientes suelen presentar una erupción facial que consiste en pequeñas pápulas parecidas al sarampión y que se propaga a otras partes del cuerpo. Este síndrome puede curarse espontáneamente, pero las recaídas son frecuentes. La enfermedad establecida suele ser difícil de tratar.
Se ha informado de leishmaniasis dérmica post-kala-azar resistente a agentes antimoniales, con una tasa de incidencia de 1 en 700 casos.
Leishmaniasis mucocutánea
La enfermedad mucocutánea, también llamada espundia en América del Sur, generalmente se desarrolla por metástasis de protozoos diseminados en lugar de por propagación local. Esta afección es causada con mayor frecuencia por especies del Nuevo Mundo, aunque también se ha informado que L. aethiopica del Viejo Mundo causa este síndrome. La infección secundaria desempeña un papel importante en el tamaño y la persistencia de las úlceras.
La infección por L. (Viannia) braziliensis puede producir afectación de las mucosas en hasta un 10% de los casos, dependiendo de la región de adquisición. El periodo de incubación es de 1 a 3 meses. La infección inicial se caracteriza por una lesión cutánea persistente que finalmente se cura, aunque hasta un 30% de los pacientes no refieren evidencia previa de leishmaniasis.
La progresión de la úlcera es lenta y constante. Varios años después, se produce la afectación de la mucosa oral y respiratoria, causando inflamación y mutilación de la nariz, boca, orofaringe y tráquea (ver la siguiente imagen), lo que produce síntomas de obstrucción nasal y sangrado. Estos pueden convertirse en focos de infección, que en ocasiones conducen a una sepsis. Se han descrito casos en los que el tiempo transcurrido entre la lesión primaria y la aparición de la afectación de la mucosa es de hasta 2 décadas.
La enfermedad mucocutánea progresiva es difícil de tratar y suele reaparecer. Si la infección se prolonga, se produce la muerte por compromiso respiratorio y desnutrición. La leishmaniasis mucocutánea puede aparecer tras un tratamiento inadecuado de ciertas especies de Leishmania .
Los niños rara vez se ven afectados.
Leishmaniasis visceral
La enfermedad visceral, la forma más devastadora y mortal de leishmaniasis, se conoce clásicamente como kala-azar o el nombre indio de “fiebre/enfermedad negra”, que es una referencia al oscurecimiento característico de la piel que se observa en los pacientes con esta afección. Otros términos utilizados para describir la enfermedad visceral incluyen fiebre de Dumdum, fiebre de Assam y esplenomegalia infantil en varias partes del mundo.
Esta afección se presenta tanto en especies del Nuevo como del Viejo Mundo y es consecuencia de una infección sistémica del hígado, el bazo y la médula ósea. El espectro de la enfermedad varía desde una infección asintomática o una enfermedad que se resuelve espontáneamente hasta una infección fulminante, grave y potencialmente mortal; se producen muchos casos subclínicos que pasan desapercibidos por cada caso clínicamente reconocido.
El síndrome se caracteriza por la pentada de fiebre, pérdida de peso, hepatoesplenomegalia, pancitopenia e hipergammaglobulinemia. La fiebre es continua o remitente y se vuelve intermitente en una etapa posterior. También se describe característicamente como una doble subida en 24 horas, en la que las oleadas de pirexia pueden ser seguidas por un período sin fiebre. Los pacientes también pueden referir sudores nocturnos, debilidad, diarrea, malestar y anorexia. Puede ocurrir estimulación de melanocitos y xerosis, causando hiperpigmentación característica de la piel.
La aparición de la enfermedad visceral puede ser insidiosa o repentina. El período de incubación varía después de la infección (generalmente de 3 a 6 meses, pero puede ser de meses o años) y puede depender de la edad y el estado inmunológico del paciente, así como de la especie de Leishmania . Los niños pequeños desnutridos son los más susceptibles a desarrollar una infección progresiva; aquellos que se presentan más tarde en el curso de la enfermedad pueden presentar edema causado por hipoalbuminemia, hemorragia causada por trombocitopenia o retraso del crecimiento causado por características de la infección crónica.
Si la enfermedad visceral no se trata, con frecuencia ocurre la muerte dentro de los 2 años, lo que puede deberse a hemorragia (secundaria a la infiltración del sistema hematopoyético), anemia grave, inmunosupresión y/o infecciones secundarias.
Se ha descrito una variante de leishmaniasis visceral en soldados estadounidenses que participaron en la Guerra del Golfo. Se asocia con una carga parasitaria leve y síntomas leves que incluyen fiebre, malestar y náuseas. Recientemente se informó de un caso solitario de leishmaniasis visceral que se presentó como hepatitis autoinmune. [ 14 ]
Leishmaniasis viscerotrópica
La leishmaniasis viscerotrópica tiene una presentación clínica indolente pero distintiva y no parece progresar a una leishmaniasis visceral completa. Los pacientes han presentado una serie de síntomas meses o años después de la infección, que incluyen fiebre, escalofríos, fatiga, malestar, tos no productiva, diarrea intermitente, dolor de cabeza, artralgias, mialgias, náuseas, adenopatía, hepatoesplenomegalia transitoria y dolor abdominal.
Aunque L. tropica se ha asociado tradicionalmente con la leishmaniasis cutánea, se han notificado varios casos de enfermedad visceral en Kenia, India e Israel. Además, los informes de pacientes que regresaron de Oriente Medio mostraron que los síntomas se presentaron entre 1 mes y 2 años después de la exposición, con muchos de los síntomas descritos anteriormente: malestar, fatiga, fiebre intermitente, tos, diarrea, dolor abdominal y otros síntomas gastrointestinales.
Examen físico
Leishmaniasis cutánea
La enfermedad cutánea puede tener las siguientes manifestaciones físicas [ 2 , 3 , 1 ] :
Leishmaniasis cutánea localizada: pápulas costrosas o úlceras en la piel expuesta; las lesiones pueden estar asociadas con propagación esporotricótica
Leishmaniasis cutánea difusa (diseminada): pápulas y nódulos cutáneos múltiples, generalizados, no dolorosos ni ulcerosos; análogos a las lesiones de lepra lepromatosa
Leishmaniasis recidivante: se presenta como una recurrencia de lesiones en el sitio de una enfermedad aparentemente curada años después de la infección original, típicamente en la cara y a menudo involucrando la mejilla; se manifiesta como una pápula, placa o coalescencia de pápulas que se agranda y se cura con una cicatriz central (es decir, lesiones en el centro o la periferia de una antigua cicatriz de leishmaniasis curada); la expansión implacable en la periferia puede causar una destrucción facial significativa similar a la variante de lupus vulgar de la tuberculosis cutánea
Leishmaniasis dérmica post-kala-azar: se desarrolla meses o años después de la recuperación del paciente de la leishmaniasis visceral, con lesiones cutáneas que van desde máculas hipopigmentadas hasta pápulas eritematosas y desde nódulos hasta placas; las lesiones pueden ser numerosas y persistir durante décadas.
La presentación de la enfermedad cutánea varía según el estadio de la enfermedad, aunque se presenta principalmente en 2 formas, (1) una llaga oriental causada por L. tropica y (2) leishmaniasis cutánea americana causada por L. brasiliensis . Las lesiones suelen encontrarse en zonas expuestas (p. ej., cara, brazos, piernas). La lesión cutánea comienza como una pápula roja, firme y no dolorosa de varios centímetros de tamaño en el sitio de la picadura del flebótomo. Con el tiempo, la lesión se oscurece, se ensancha con ulceración central, formación de costras serosas y granuloma. El borde a menudo tiene un borde eritematoso elevado conocido como signo del volcán.
 La lesión clásica de Leishmania major de un caso en Irak muestra un aspecto volcánico con bordes enrollados.
La lesión clásica de Leishmania major de un caso en Irak muestra un aspecto volcánico con bordes enrollados.Las lesiones pueden estar húmedas o abiertas con exudado seropurulento, o las úlceras pueden estar secas con una costra y volverse fibróticas o hiperqueratósicas con la curación (después de aproximadamente 3 a 6 meses, dejando un borde elevado).
 Lesiones cutáneas de leishmaniasis curadas. Fotografía cortesía de Robert Norris, MD, Stanford University Medical Center.
Lesiones cutáneas de leishmaniasis curadas. Fotografía cortesía de Robert Norris, MD, Stanford University Medical Center.La leishmaniasis cutánea urbana, causada por una subespecie de L. tropica, se presenta como una úlcera cutánea seca en la cara y tiene una distribución urbana. El período de incubación es de aproximadamente 2 meses. Es común en la India occidental, el norte de África, la región mediterránea y Oriente Medio. Una enfermedad similar en México, Honduras y Guatemala se conoce como úlcera chiclera. Es una lesión crónica que se presenta en el lugar de la picadura de un flebótomo.
La leishmaniasis cutánea rural es causada por L. tropica y tiene una distribución rural. Aparecen múltiples lesiones cutáneas húmedas en las extremidades y se asocian con una marcada infiltración subcutánea local y linfadenitis regional. Ambas lesiones son comunes en Asia central.
Otros hallazgos de la enfermedad cutánea incluyen lesiones eccematosas, psoriasiformes, variceliformes y verrugosas. El área que rodea la lesión primaria puede presentar diseminación linfangítica con cordones palpables y nódulos subcutáneos. Esto es común en las lesiones del Nuevo Mundo causadas por infecciones por L. (Viannia) braziliensis .
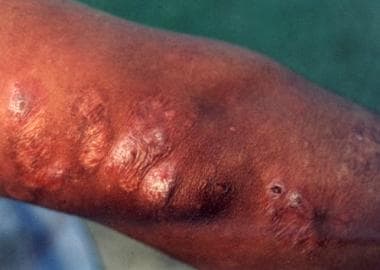
Pueden presentarse adenopatías regionales, nódulos subcutáneos y lesiones satélites. Las lesiones suelen ser indoloras y sin prurito. Puede presentarse una reacción inflamatoria generalizada a los parásitos migratorios en la piel que rodea la llaga. La infección bacteriana suprayacente puede complicar la evolución natural. La curación se produce en meses o años, dejando una cicatriz hipopigmentada retraída característica. Las llagas no tratadas pueden dejar cicatrices retraídas despigmentadas. Por lo tanto, aunque esta forma suele curarse por sí sola, puede provocar una discapacidad grave y cicatrices permanentes.
 Leishmaniasis cutánea localizada del Viejo Mundo localizada en el tronco de un soldado destinado en Kuwait. Esta lesión era una ulceración no dolorosa de 3 cm por 4 cm que se desarrolló en el transcurso de 6 meses en el lugar de la picadura de un flebótomo. El paciente informó haber visto varias ratas alrededor de su campamento.
Leishmaniasis cutánea localizada del Viejo Mundo localizada en el tronco de un soldado destinado en Kuwait. Esta lesión era una ulceración no dolorosa de 3 cm por 4 cm que se desarrolló en el transcurso de 6 meses en el lugar de la picadura de un flebótomo. El paciente informó haber visto varias ratas alrededor de su campamento.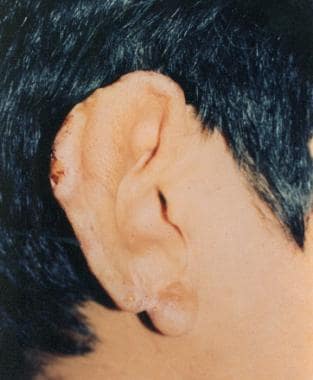 Lesiones cutáneas de leishmaniasis. Fotografía cortesía de Robert Norris, MD, Stanford University Medical Center.
Lesiones cutáneas de leishmaniasis. Fotografía cortesía de Robert Norris, MD, Stanford University Medical Center.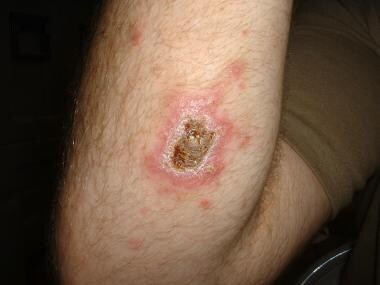 Aspecto atípico de una lesión de Leishmania major con diseminación local más allá de los límites de la lesión primaria. Muchas de las lesiones en casos de Irak muestran un aspecto atípico.
Aspecto atípico de una lesión de Leishmania major con diseminación local más allá de los límites de la lesión primaria. Muchas de las lesiones en casos de Irak muestran un aspecto atípico.Leishmaniasis dérmica post-kala azar
Las lesiones dérmicas post-kala-azar se clasifican en tres tipos, como sigue:
Máculas despigmentadas: Las lesiones más tempranas; presentes en el tronco y las extremidades.
Manchas eritematosas: aparecen al principio de la enfermedad; se observan en la nariz, las mejillas y el mentón, con una distribución en forma de mariposa; son fotosensibles y se vuelven prominentes hacia el mediodía.
Nódulos de color rosa amarillento: aparecen principalmente en la cara y reemplazan las lesiones anteriores; la ausencia de ulceración distingue estos nódulos de los de la leishmaniasis cutánea (llaga oriental)
Leishmaniasis mucocutánea
La leishmaniasis mucocutánea consiste en la destrucción implacable de la orofaringe y la nariz, dando lugar a una extensa destrucción de la zona media de la cara.
La lesión cutánea inicial de la enfermedad mucocutánea suele caracterizarse por un tiempo de curación prolongado y un gran tamaño. En la mayoría de los casos, se puede identificar una cicatriz curada mediante un examen minucioso. Meses o años después de la infección inicial, los pacientes pueden presentar rinorrea, epistaxis y congestión nasal.
La lesión suele aparecer en la unión mucocutánea alrededor de la nariz y puede extenderse hacia adentro, destruyendo tejidos y provocando una deformidad que requiere cirugía plástica. La lesión se cura dejando cicatrices, lo que provoca la típica nariz de tapir o camello.
El examen revela las siguientes características:
Tejido excesivo que obstruye las fosas nasales, granulación septal y perforación; el cartílago nasal puede estar afectado, dando lugar a cambios externos conocidos como pico de loro o nariz de camello.
Posible presencia de granulación, erosión y ulceración del paladar, úvula, labios, faringe y laringe, con conservación de las estructuras óseas; la ronquera puede ser un signo de afectación laríngea.
Gingivitis, periodontitis
Linfadenopatía localizada
Afectación de la mucosa genital y óptica en casos graves
La muerte ocurre por asfixia secundaria a obstrucción de las vías respiratorias, infección respiratoria y neumonía por aspiración.
Leishmaniasis visceral
La enfermedad visceral y viscerotrópica puede manifestarse con los siguientes hallazgos físicos:
Leishmaniasis visceral (kala-azar): enfermedad sistémica generalizada potencialmente letal que se caracteriza por oscurecimiento de la piel, así como por la pentada de fiebre, pérdida de peso, hepatoesplenomegalia, pancitopenia e hipergammaglobulinemia.
Leishmaniasis viscerotrópica: Dolor abdominal inespecífico; fiebre, escalofríos, fatiga, malestar, tos no productiva, diarrea intermitente, dolor de cabeza, artralgias, mialgias, náuseas, adenopatía, hepatoesplenomegalia transitoria.
Los pacientes con leishmaniasis visceral se ven delgados y caquécticos, con distensión abdominal y protuberancia debido a una hepatoesplenomegalia masiva (secundaria a la producción compensatoria de células sanguíneas fagocíticas) (ver la imagen a continuación). El hígado y el bazo suelen ser blandos y fáciles de palpar en la enfermedad aguda, con extensión esplénica hasta muy por debajo del reborde costal, y el paciente puede experimentar malestar abdominal intermitente. La ictericia con niveles de enzimas levemente elevados se observa raramente y se considera un signo de mal pronóstico.
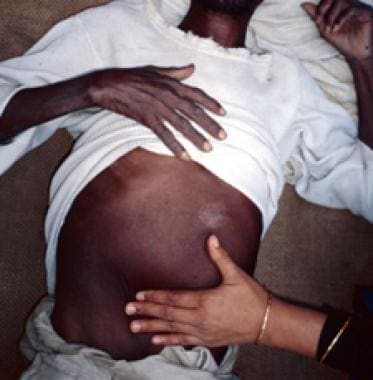 Esplenomegalia marcada (agrandamiento/hinchazón del bazo) en un paciente de las tierras bajas de Nepal que padece leishmaniasis visceral. (Crédito: C. Bern, CDC) Fuente: Centros para el Control y la Prevención de Enfermedades. Página de inicio de parásitos: leishmaniasis. Recursos para profesionales de la salud: https://www.cdc.gov/parasites/leishmaniasis/health_professionals/.
Esplenomegalia marcada (agrandamiento/hinchazón del bazo) en un paciente de las tierras bajas de Nepal que padece leishmaniasis visceral. (Crédito: C. Bern, CDC) Fuente: Centros para el Control y la Prevención de Enfermedades. Página de inicio de parásitos: leishmaniasis. Recursos para profesionales de la salud: https://www.cdc.gov/parasites/leishmaniasis/health_professionals/.Pueden presentarse epistaxis, petequias y equimosis por trombocitopenia grave. La anemia es normocrómica y normocítica y es causada por diversos factores, entre ellos, la sustitución de la médula ósea por los parásitos, el secuestro esplénico, la hemorragia, la hemodilución y la hemólisis. También se observa leucopenia, que puede contribuir a las infecciones secundarias. La trombocitopenia contribuye a la tendencia hemorrágica observada en algunos casos.
La linfadenopatía se observa en las formas africana y china, pero rara vez se observa en la forma india. El edema de los pies es más común en los niños. Pueden presentarse cambios en el cabello, como alopecia y alargamiento de las pestañas. A medida que la enfermedad progresa, se ha descrito un oscurecimiento irregular característico de la cara y el tronco, que también puede afectar las manos y los pies.
En la leishmaniasis visceral pueden aparecer lesiones cutáneas que contienen parásitos y que aparecen como lesiones difusas, verrugosas y no ulcerativas, especialmente en África. Aunque es poco frecuente, puede aparecer xerosis. Las complicaciones de la leishmaniasis visceral incluyen amiloidosis, glomerulonefritis y cirrosis.
En pacientes coinfectados con el virus de la inmunodeficiencia humana (VIH) y leishmaniasis visceral, otros hallazgos atípicos incluyen afectación gastrointestinal y respiratoria. Los pacientes han presentado ulceraciones gastrointestinales, masas, derrames pleurales y odinofagia. La diseminación fuera del sistema reticuloendotelial parece ser más común.
Las presentaciones clínicas inusuales de la leishmaniasis visceral incluyen las siguientes:
Pancitopenia sin esplenomegalia
Hemólisis inmunomediada
Linfadenopatía generalizada sin hepatoesplenomegalia
Necrosis hepática masiva
Enfermedad hepática crónica
Hemorragias retinianas (notificadas en pacientes inmunodeficientes)
Consideraciones diagnósticas
Como se señaló anteriormente, la infección con diferentes especies de Leishmania puede provocar una gama notablemente amplia de estados patológicos. El espectro clínico puede variar desde pústulas insignificantes hasta una enfermedad sistémica mortal. [ 2 , 3 , 1 ] La comprensión general de este espectro clínico, aunque alguna vez se creyó que era bastante predecible, continúa evolucionando a medida que nuevas técnicas de diagnóstico contribuyen a la elucidación de la variedad de manifestaciones clínicas de una infección con incluso una sola especie de Leishmania .
Las enfermedades infecciosas coexistentes y/o las deficiencias nutricionales pueden afectar significativamente la gravedad y el pronóstico de la infección por leishmaniasis. En el sur de Europa, a lo largo del Mediterráneo, la leishmaniasis visceral está surgiendo, sobre todo, como una infección oportunista grave en personas con infección por el virus de la inmunodeficiencia humana (VIH), donde la mayoría de los pacientes adultos (< 70%) con leishmaniasis visceral tienen síndrome de inmunodeficiencia adquirida (SIDA) en etapa avanzada. Las personas con infección por VIH y leishmaniasis tienen cargas parasitarias más altas, respuestas más pobres a las pruebas cutáneas, respuestas más bajas al antimonio pentavalente y tasas de recaída postratamiento más altas que las de sus contrapartes inmunocompetentes. [ 15 ]
Leishmaniasis cutánea
La leishmaniasis cutánea localizada suele manifestarse como una úlcera inespecífica que puede imitar muchas otras enfermedades cutáneas infecciosas y no infecciosas. La gran mayoría de los casos se manifiestan espontáneamente con cicatrices y nunca llegan a la atención de los médicos. Incluso en las tropas estadounidenses estacionadas en Irak, muchos de los más estrechamente relacionados con la enfermedad y familiarizados con la epidemiología militar han tenido la impresión de que menos del 25% de todas las enfermedades afectan a los soldados afectados lo suficiente como para buscar atención médica.
Otras condiciones a considerar en el diagnóstico diferencial de la leishmaniasis incluyen las siguientes:
Fúngicos: cromoblastomicosis , lobomicosis, infección fúngica profunda
Bacterias: difteria cutánea, rinoescleroma , pioderma tropical y otras micobacteriosis (p. ej., infección de la piel por Mycobacterium avium-intracellulare y Mycobacterium marinum )
Viral: Orf
Enfermedades inflamatorias: Granuloma piógeno, dermatitis numular , psoriasis en placas.
Neoplasias malignas: Metástasis, psoriasis, queloides
Úlceras: úlceras traumáticas, úlceras por estasis.
Leishmaniasis mucocutánea
Otras condiciones a considerar en el diagnóstico diferencial de la leishmaniasis mucocutánea incluyen las siguientes:
Reticulosis polimórfica
Granulomatosis de Wegener
Linfoma (p. ej., linfoma angiocéntrico de células NK/T)
Carcinoma nasofaríngeo
Granuloma letal de la línea media
Otras lesiones destructivas
Leishmaniasis visceral
La leishmaniasis visceral puede confundirse con otras enfermedades infecciosas o sistémicas febriles. En las zonas endémicas, el diagnóstico de leishmaniasis visceral suele realizarse basándose en la historia clínica y el examen físico.
Otras condiciones a considerar en el diagnóstico diferencial de la leishmaniasis visceral incluyen las siguientes:
Brucelosis
esquistosomiasis
Leucemia (p. ej., leucemia linfoblástica aguda , leucemia mielógena aguda ) y linfoma ( leucemia linfocítica crónica , leucemia mielógena crónica )
Hipertensión portal
Desnutrición
Diagnósticos diferenciales
Linfoma cutáneo de células T
Medicina Física y Rehabilitación para el Lupus Eritematoso Sistémico
Pioderma gangrenoso
Carcinoma de células escamosas
Pian
Consideraciones sobre el enfoque
Históricamente, el diagnóstico de leishmaniasis se ha confirmado mediante el aislamiento, la visualización y el cultivo del parásito a partir del tejido infectado. [ 2 , 3 , 1 , 16 ] Para confirmar la enfermedad cutánea, los procedimientos consisten principalmente en realizar biopsias y obtener raspados dérmicos y/o aspirados con aguja. Los frotis se tiñen con tinciones de Leishman, Giemsa o Wright y se examinan con un microscopio de inmersión en aceite.
En el caso de la enfermedad visceral, el parásito puede detectarse mediante evidencia directa (amastigotes en el tejido) en sangre periférica, médula ósea, hígado o aspirados esplénicos. El método más sensible es la punción esplénica, aunque las complicaciones iatrogénicas pueden ser graves, incluida una hemorragia potencialmente mortal. En la práctica actual, la alta sensibilidad y especificidad del ensayo de K39 recombinante ha hecho que, en general, estos procedimientos invasivos sean innecesarios.
En las zonas endémicas, el diagnóstico de leishmaniasis suele realizarse basándose en la historia clínica y el examen físico. Muy pocas de las pruebas diagnósticas que se analizan en las secciones siguientes están disponibles en los países en desarrollo.
En las formas cutáneas y mucocutáneas localizadas de leishmaniasis, la inmunidad celular contra el parásito es vigorosa y la densidad de organismos en la piel y/o las mucosas es baja, especialmente en la enfermedad de larga duración (aunque en etapas muy tempranas de la enfermedad se encuentran con frecuencia grandes cantidades de parásitos). Por lo tanto, el crecimiento de organismos en cultivos puede ser difícil, al igual que su hallazgo en muestras patológicas.
Los Centros para el Control y la Prevención de Enfermedades (CDC) han publicado una guía práctica para el diagnóstico de laboratorio de la leishmaniasis . Cabe señalar que la guía de los CDC no aborda las pruebas serológicas.
Leishmaniasis cutánea
En más del 70% de los casos de leishmaniasis cutánea, la microscopía del parásito en tinciones de Giemsa o en un corte histológico puede revelar el parásito y debe intentarse primero. El cultivo de los organismos es una opción, pero no es confiable (sensibilidad de aproximadamente el 40%), porque los organismos son difíciles de aislar de la lesión, especialmente a medida que la lesión se hace más antigua. En consecuencia, el diagnóstico a menudo es epidemiológico (viaje a una zona endémica, cuadro clínico, junto con datos de laboratorio).
El organismo crece en medios líquidos con suero fetal bovino (por ejemplo, medio Schneider Drosophila ) (resultados positivos en 1 semana) y medio Novy-MacNeal-Nicolle (NNN) (medio disponible en los CDC), o un medio bifásico. Los cultivos pueden producir resultados positivos en 1-3 semanas.
Leishmaniasis sistémica
Se ha adquirido una experiencia considerable y se han obtenido éxitos con el uso de aspirados de médula ósea (y especialmente un pequeño trozo del tejido central espiculado) para cultivar el parásito o para buscar macrófagos llenos de amastigotes en los frotis de aspirado de médula ósea teñidos.
Se han desarrollado diversas pruebas serológicas inmunodiagnósticas para ayudar en el diagnóstico de la leishmaniasis sistémica. Sin embargo, las únicas pruebas serológicas que se han utilizado con éxito se limitan a las especies de Leishmania que causan enfermedad visceral. Las limitaciones incluyen resultados serológicos falsos negativos debido a títulos inadecuados de anticuerpos en etapas avanzadas del curso de la enfermedad y resultados falsos positivos en el contexto de otras enfermedades infecciosas o autoinmunes.
Las pruebas serológicas son útiles con la prueba de anticuerpos fluorescentes indirectos (IFA), que tiene una sensibilidad del 80 al 100% en pacientes con leishmaniasis visceral que no están infectados con el virus de la inmunodeficiencia humana (VIH). Sin embargo, la IFA puede presentar una reacción cruzada en pacientes con lepra, tuberculosis, malaria, esquistosomiasis, enfermedad de Chagas y tripanosomiasis africana. Las pruebas serológicas como el análisis de isoenzimas o de anticuerpos monoclonales no están bien establecidas.
Se puede combinar un ensayo inmunoabsorbente ligado a enzimas (ELISA) con inmunofluorescencia directa y/o inmunotransferencia para aumentar la sensibilidad y la especificidad. La reacción en cadena de la polimerasa (PCR) se está utilizando con más frecuencia; es más precisa para determinar la leishmaniasis de nueva aparición que las pruebas séricas (sensibilidad del 92-99%; especificidad del 100%). La secuenciación genómica en frotis de médula ósea para el diagnóstico de parásitos puede tener un papel en el futuro. (64)
Estudios de laboratorio de rutina
La leishmaniasis cutánea y mucocutánea generalmente presenta valores de laboratorio normales. [ 2 , 3 , 1 , 16 ]
Pruebas hematológicas
Recuento sanguíneo completo (CSC)
En pacientes con leishmaniasis visceral, puede presentarse (1) anemia normocítica normocrómica, (2) leucopenia con disminución de neutrófilos y una relativa monocitosis y linfocitosis, y (3) trombocitopenia debido a la infiltración parasitaria de la médula ósea. La gravedad de la pancitopenia puede variar con solo una o dos líneas celulares disminuidas.
Estudios de coagulación
Los tiempos de protrombina y tromboplastina parcial son generalmente normales en la leishmaniasis visceral.
Frotis de sangre periférica
Los amastigotes se encuentran en el interior de los monocitos y neutrófilos circulantes, pero suelen ser difíciles de localizar debido a su reducido número.
La mejor forma de detectar L. donovani es (1) creando una película gruesa produciendo un único borde recto de leucocitos al hacer un frotis periférico o (2) centrifugando sangre citratada y retirando el sedimento, que luego se unta, se seca y se tiñe.
El diagnóstico parasitológico mediante frotis de sangre periférica y frotis de capa leucocítica es más fácil en pacientes con coinfección por el virus de la inmunodeficiencia humana (VIH), porque los parásitos se encuentran más comúnmente en los monocitos circulantes de estos pacientes.
Pruebas de función hepática (PFH)
Los pacientes con leishmaniasis visceral pueden presentar elevaciones leves en los niveles de fosfatasa alcalina, aspartato aminotransferasa (AST) y alanina aminotransferasa (ALT).
Otras pruebas
En el suero de la mayoría de los pacientes con leishmaniasis visceral se encuentran hipogammaglobulinemia, inmunocomplejos circulantes y factores reumatoides. En raras ocasiones, el depósito de inmunocomplejos en los riñones puede provocar una glomerulonefritis leve. Sin embargo, la insuficiencia renal no es una característica de la leishmaniasis visceral.
Las pruebas auxiliares importantes en el diagnóstico de la enfermedad visceral incluyen mediciones de lipasa, amilasa, gammaglobulina y albúmina.
La prueba del aldehído y la prueba del antimonio fueron las pruebas iniciales utilizadas para detectar la hipogammaglobulinemia y diagnosticar la leishmaniasis visceral. Los hallazgos incluyen niveles elevados de gammaglobulina y una inversión de la relación albúmina-globulina.
Para la prueba de aldehídos, obtenga aproximadamente 1 ml de sangre en un tubo de vidrio pequeño y agregue 1 o 2 gotas de formalina al 40 %. La formación de una opacidad blanquecina lechosa y la gelificación indican un resultado positivo. Los resultados de la prueba de aldehídos no son positivos a menos que la enfermedad haya estado presente durante al menos 3 meses.
Los resultados de la prueba de antimonio también dependen de un aumento en los niveles séricos de gammaglobulina. Los resultados positivos se indican mediante un precipitado floculante blanco que se observa cuando una solución de urea estibamina entra en contacto con el suero.
Biopsia y/o Aspiración
Leishmaniasis cutánea
En el caso de la leishmaniasis cutánea, se debe tomar una muestra de biopsia en cuña o en sacabocados de 3 mm de una llaga cutánea del borde elevado de una lesión activa donde haya parásitos. [ 16 ] Evite tomar muestras del centro necrótico. Se puede obtener tejido adicional mediante aspiración con solución salina, raspados de tejido o incisiones.
Una vez obtenido el tejido, envíe preparaciones de contacto, portaobjetos de impresión de tejido y secciones de parafina fijadas con formalina para tinción con hematoxilina y eosina. Envíe también preparaciones de contacto y aspiraciones para tinción de Giemsa. La visualización directa de los amastigotes con su cinetoplasto citoplasmático rojo en forma de bastón es diagnóstica y ayuda a distinguirlos de otros parásitos (ver la imagen a continuación). La tinción de Brown-Hopps tiene una mayor sensibilidad que otras técnicas de tinción.
La detección de un organismo en una muestra de tejido depende de la carga parasitaria, la eficacia de la respuesta inmunitaria del huésped, cualquier contaminación bacteriana coexistente en la úlcera y la edad de la lesión (los hallazgos en lesiones más antiguas con frecuencia no son diagnósticos).
Leishmaniasis mucocutánea
En el caso de la leishmaniasis mucocutánea, se puede obtener tejido mediante raspados dentales o biopsia de granuloma mucoso, aunque puede resultar difícil aislar los parásitos. A menudo se observa una reacción granulomatosa inespecífica. La tinción de Giemsa puede mostrar los organismos.
Leishmaniasis visceral
Históricamente, los aspirados de médula ósea, hígado o bazo eran la clave para el diagnóstico de laboratorio de la enfermedad visceral, pero en la práctica actual la alta sensibilidad y especificidad del ensayo recombinante K39 generalmente ha hecho que tal invasión sea innecesaria.
La forma más segura y habitual de obtener tejido es mediante aspiración de médula ósea obtenida del esternón o de la cresta ilíaca, aunque se puede utilizar la aspiración esplénica en casos de difícil diagnóstico. Las formas amastigotes se revelan en la placa simple y las formas promastigotes en el cultivo. Aunque es más segura que la punción esplénica, los parásitos son escasos y pueden dar un resultado falso negativo. Se han obtenido tasas de positividad del 54-86% utilizando médula ósea.
La aspiración esplénica tiene una mayor sensibilidad que la aspiración de médula ósea (se han obtenido hasta un 98% de resultados positivos con la aspiración esplénica), pero este procedimiento solo debe ser intentado por médicos experimentados. La punción esplénica se asocia con el riesgo de hemorragia no controlada y, por lo tanto, debe realizarse solo cuando los hallazgos del examen de médula ósea no sean concluyentes. Las contraindicaciones incluyen recuento bajo de plaquetas, tiempo de protrombina anormal y un bazo que se palpa a 4 cm o menos por debajo del ángulo costofrénico.
Se puede obtener tejido adicional mediante biopsia de hígado y disección de ganglios linfáticos.
Hallazgos histológicos
La leishmaniasis es una enfermedad que afecta al sistema reticuloendotelial. Los macrófagos parasitados diseminan la infección a todas las partes del cuerpo, especialmente al bazo, el hígado y la médula ósea. [ 1 ]
Identificación de organismos
La visualización directa del organismo Leishmania es diagnóstica, pero puede ser difícil en cortes de tejido debido a su pequeño tamaño (2-4 mm) y a las sutiles características distintivas que se observan en las tinciones habituales con hematoxilina y eosina (H&E). El diagnóstico suele ser mucho más fácil utilizando preparaciones de contacto teñidas con Giemsa.
Independientemente del método de preparación, la identificación suele requerir un patólogo experimentado y búsquedas prolongadas con gran aumento, en particular cuando los organismos son escasos. Las tinciones de Giemsa, Brown-Hopps, Gram o Leishman se utilizan para realzar los organismos de Leishmania en preparaciones de contacto, aspiración de tejido o muestras de biopsia.
El parásito consta de un núcleo y un cinetoplasto rodeados por una pared celular. Para realizar un diagnóstico basado en los hallazgos microscópicos, es necesario visualizar las tres características (es decir, el núcleo, la membrana celular y el cinetoplasto).
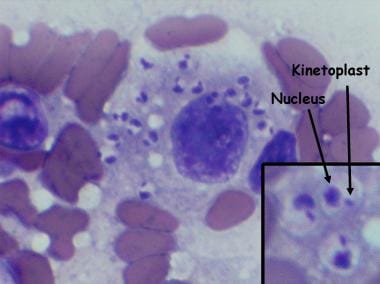 Amastigotes en un macrófago con un aumento de 1000×. El recuadro muestra la membrana celular y señala el núcleo y el cinetoplasto, que son necesarios para confirmar que la inclusión observada en un macrófago es, en efecto, un amastigote.
Amastigotes en un macrófago con un aumento de 1000×. El recuadro muestra la membrana celular y señala el núcleo y el cinetoplasto, que son necesarios para confirmar que la inclusión observada en un macrófago es, en efecto, un amastigote. Amastigotes libres cerca de un macrófago desintegrado. En preparaciones táctiles como ésta (tinción de Giemsa, aumento original × 1000), los amastigotes son más fáciles de identificar que en otras preparaciones. Estas tinciones muestran claramente la membrana celular, el núcleo y el cinetoplasto; los tres son necesarios para el diagnóstico definitivo.
Amastigotes libres cerca de un macrófago desintegrado. En preparaciones táctiles como ésta (tinción de Giemsa, aumento original × 1000), los amastigotes son más fáciles de identificar que en otras preparaciones. Estas tinciones muestran claramente la membrana celular, el núcleo y el cinetoplasto; los tres son necesarios para el diagnóstico definitivo.La sensibilidad diagnóstica de la identificación microscópica de amastigotes de Leishmania es típicamente del 75-85%, pero puede variar ampliamente, dependiendo del tamaño del inóculo, la experiencia del médico en tomar muestras de un área apropiada, la experiencia del personal de laboratorio en hacer frotis o secciones de tejido y la experiencia del observador en encontrar el parásito.
La mayoría de los expertos en Leishmania creen que la forma ideal de identificar microscópicamente el parásito es con preparaciones de contacto directo de la lesión o tejido de biopsia teñido con Giemsa en lugar de secciones de tejido de rutina.
Características hepatoesplénicas en la enfermedad visceral
El bazo está agrandado, con un engrosamiento de la cápsula; es blando y frágil; sus espacios vasculares están dilatados y congestionados de sangre; y las células reticulares de Billroth están marcadamente aumentadas y repletas de formas amastigotes del parásito. Sin embargo, no hay evidencia de fibrosis.
En el hígado, las células de Kupffer están aumentadas de tamaño y número y están infectadas con formas amastigotes de Leishmania. La médula ósea está hiperplásica y los macrófagos parasitados sustituyen al tejido hematopoyético normal.
Enfermedad cutánea
La leishmaniasis cutánea localizada se caracteriza por una acantosis irregular, con o sin ulceración epidérmica, y un infiltrado dérmico denso de células inflamatorias mixtas, en particular células plasmáticas, linfocitos e histiocitos. Al principio de la enfermedad localizada, los microorganismos pueden ser numerosos y encontrarse fácilmente en el citoplasma de los macrófagos. A medida que la lesión envejece y se regula positivamente la inmunidad de tipo retardado, el infiltrado es reemplazado por granulomas no caseosos en los que se pueden ver pocos o ningún microorganismo.
Las lesiones ulceradas suelen ser infectadas secundariamente por bacterias, en cuyo caso los cambios histológicos pueden ser inespecíficos. Los resultados de las biopsias obtenidas de infecciones antiguas (de más de 6 meses de duración), parcialmente tratadas o de baja incidencia no suelen ser diagnósticos.
La leishmaniasis cutánea difusa se presenta en individuos con inmunidad celular deficiente a los parásitos Leishmania . El diagnóstico histológico es sencillo en estos casos. La dermis contiene láminas de macrófagos que contienen gran cantidad de amastigotes, con pocos linfocitos o células plasmáticas.
La leishmaniasis recidivante suele ser difícil de confirmar debido a la rareza de los organismos y a su similitud histológica con el lupus vulgar.
La leishmaniasis dérmica post-kala-azar tiene una histología variable que está determinada por el grado de inmunidad del huésped y la carga parasitaria. La histología granulomatosa se observa con un bajo número de organismos, mientras que los infiltrados histiocíticos o xantomatosos difusos pueden observarse con numerosos organismos.
Leishmaniasis visceral
El diagnóstico definitivo de la enfermedad visceral se realiza mediante la observación del parásito (más específicamente, los amastigotes en el tejido) en frotis teñidos de Giemsa o mediante la observación del cultivo de aspirados de médula ósea, bazo, hígado o ganglios linfáticos.
 Examen con microscopio óptico de una muestra teñida de médula ósea de un paciente con leishmaniasis visceral, que muestra un macrófago (un tipo especial de glóbulo blanco) que contiene múltiples amastigotes de Leishmania (la etapa tisular del parásito). Nótese que cada amastigoto tiene un núcleo (flecha roja) y un cinetoplasto en forma de bastón (flecha negra). La visualización del cinetoplasto es importante para fines de diagnóstico, para estar seguros de que el paciente tiene leishmaniasis. (Crédito: CDC/DPDx) Fuente: Centros para el Control y la Prevención de Enfermedades. Página de inicio de parásitos: leishmaniasis. Recursos para profesionales de la salud: https://www.cdc.gov/parasites/leishmaniasis/health_professionals/
Examen con microscopio óptico de una muestra teñida de médula ósea de un paciente con leishmaniasis visceral, que muestra un macrófago (un tipo especial de glóbulo blanco) que contiene múltiples amastigotes de Leishmania (la etapa tisular del parásito). Nótese que cada amastigoto tiene un núcleo (flecha roja) y un cinetoplasto en forma de bastón (flecha negra). La visualización del cinetoplasto es importante para fines de diagnóstico, para estar seguros de que el paciente tiene leishmaniasis. (Crédito: CDC/DPDx) Fuente: Centros para el Control y la Prevención de Enfermedades. Página de inicio de parásitos: leishmaniasis. Recursos para profesionales de la salud: https://www.cdc.gov/parasites/leishmaniasis/health_professionals/Cultivo de tejidos
Regularmente se obtienen cultivos de tejido in vitro para ayudar en el diagnóstico de la leishmaniasis y para ayudar a identificar especies difíciles de Leishmania . [ 1 ] Esta técnica tiene aproximadamente la misma sensibilidad diagnóstica que la evaluación patológica, pero se requieren capacidades de laboratorio y habilidades técnicas especiales. Estas están disponibles en solo 2 laboratorios de referencia en los Estados Unidos (es decir, los Centros para el Control y la Prevención de Enfermedades [CDC], el Instituto de Investigación del Ejército Walter Reed).
El valor de este método es que las especies del parásito se pueden identificar sobre la base de patrones de isoenzimas estandarizados durante mucho tiempo en la electroforesis de acetato de celulosa después de que el parásito se cultiva in vitro utilizando los métodos del Nuevo Mundo de Kreutzer y los métodos del Viejo Mundo de Dedet.
Las muestras se pueden cultivar en medio Novy-MacNeal-Nicolle (NNN) (agar sangre de conejo que tiene una capa de solución de Locke con antibióticos añadidos), agar sangre de conejo, medio Schneider Drosophila o una multitud de medios especializados para inducir el crecimiento de promastigotes. Los cultivos suelen tardar entre unos días y dos semanas en demostrar el crecimiento. Los resultados positivos del cultivo se dan aproximadamente el 75 % de las veces.
Se pueden realizar cultivos adicionales inoculando tejido en la almohadilla de la pata y la nariz de hámsteres o ciertas cepas de ratones altamente susceptibles (es decir, cultivos in vivo mediante inoculación animal). Este es un método sensible, especialmente en casos difíciles, pero los resultados pueden tardar varias semanas o meses.
Si el cultivo es exitoso, el parásito puede enviarse a instalaciones especializadas o a los Centros para el Control y la Prevención de Enfermedades (CDC) para realizar la reacción en cadena de la polimerasa (PCR), la electroforesis de isoenzimas o la especiación de anticuerpos monoclonales.
Estudios serológicos
Los antígenos específicos de leishmaniasis preparados a partir de cultivos se han utilizado en varias pruebas. [ 1 ] La detección serológica de anticuerpos contra el antígeno K39 recombinante (p. ej., prueba inmunocromatográfica K39, prueba de tira K39) [ 17 ] (ver la siguiente imagen) utilizando una prueba de aglutinación directa (DAT), un ensayo de inmunofluorescencia (IFA) o un ensayo inmunoabsorbente ligado a enzimas (ELISA) ha demostrado ser altamente sensible y específica para diagnosticar la leishmaniasis visceral y la leishmaniasis dérmica post-kala-azar. [ 18 ] También se ha utilizado una prueba de tira reactiva de nitrocelulosa con la prueba K39.
 Ilustración de una forma de la prueba rK39 para el diagnóstico serológico de la leishmaniasis visceral. Es una prueba fácil, muy sensible y específica para la enfermedad visceral. En este caso, la segunda tira reactiva desde la izquierda muestra un resultado positivo y todas las demás muestran reacción solo en la línea de control.
Ilustración de una forma de la prueba rK39 para el diagnóstico serológico de la leishmaniasis visceral. Es una prueba fácil, muy sensible y específica para la enfermedad visceral. En este caso, la segunda tira reactiva desde la izquierda muestra un resultado positivo y todas las demás muestran reacción solo en la línea de control.La reactividad recombinante de K39 parece correlacionarse con la enfermedad visceral activa causada por L. donovani , L. chagasi y L. infantum y está ausente en infecciones cutáneas y mucocutáneas. Los estudios confirmaron su utilidad diagnóstica en India y Brasil, pero mostraron una utilidad limitada en Sudán debido a la variación regional de las especies. [ 19 , 20 , 21 ] Es importante señalar que pueden ocurrir reacciones cruzadas con la lepra, la enfermedad de Chagas, la malaria y la esquistosomiasis.
La prueba de antígeno basada en K39 es la única prueba serológica rápida aprobada por la FDA disponible que ha sido sometida a los rigores necesarios de las pruebas científicas para ser confiable en el diagnóstico de leishmaniasis visceral. [ 22 , 23 ]
La DAT detecta el anticuerpo específico de inmunoglobulina M (IgM) en una etapa temprana y se ha demostrado que es útil en la detección de infecciones de leishmaniasis tanto clínicas como subclínicas. Debido a que esta prueba es fácil de realizar y los resultados están disponibles en 24 horas, se puede utilizar como una prueba rápida en entornos de atención primaria.
Antes de que se utilizaran antígenos específicos de leishmania, se utilizaban antígenos no específicos, como el antígeno de Witebsky, Kingenstein, Kuhn (WKK) del bacilo tuberculoso y un antígeno del bacilo ácido-alcohol resistente de Kedrowsky. Se producen resultados falsos positivos en pacientes con tuberculosis, lepra e infección tropical por eosinofilia .
Reacción en cadena de la polimerasa
En los últimos años, los avances significativos en las técnicas de reacción en cadena de la polimerasa (PCR) han permitido el diagnóstico altamente sensible y rápido de especies específicas de Leishmania . [ 1 ] La PCR puede identificar el ADN del parásito utilizando secuencias de la región variable del ADN del cinetoplasto. [ 24 ] Sin embargo, un resultado negativo de una prueba serológica no excluye la posibilidad de una infección por Leishmania.
Aunque se limita a los laboratorios militares y de referencia, el diagnóstico de la leishmania mediante PCR está cada vez más disponible en los laboratorios y sitios de campo del mundo en desarrollo. [ 25 , 26 ] Incluso en lugares remotos y en condiciones duras, esta técnica ha demostrado su valor, como lo demuestra la experiencia del ejército estadounidense con la infección por Leishmania en Irak. Los estudios genéticos moleculares se pueden realizar en diversas muestras, incluida la sangre, la médula ósea o el tejido. [ 27 ]
Existen iniciadores de PCR específicos de género validados y se ha solicitado la aprobación de este ensayo por parte de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) para que pueda utilizarse en instalaciones de todo el mundo certificadas por el Colegio de Patólogos Estadounidenses (CAP). Las sondas de PCR específicas de especie permiten una rápida especiación en casos confirmados de leishmaniasis y algunas están en proceso de validación final.
Nota: Aunque muchos laboratorios en todo el mundo ofrecen diagnósticos de PCR a nivel de especie, pocos han sido sometidos al rigor científico de la validación completa necesaria para garantizar la precisión de estos diagnósticos de especies. Muchos de estos ensayos son sospechosos y pueden ser engañosos.
Por lo tanto, en los Estados Unidos, se debe solicitar la aprobación de la FDA para estos ensayos, o bien realizarlos en laboratorios certificados para tener confianza en los resultados. Los casos difíciles se deben derivar a laboratorios de referencia en los Estados Unidos para un diagnóstico y especiación rápidos, como el Laboratorio de Diagnóstico de Leishmania del Instituto de Investigación del Ejército Walter Reed o el Laboratorio de Diagnóstico de Leishmania de los Centros para el Control y la Prevención de Enfermedades (CDC) de los Estados Unidos.
Electroforesis
En la leishmaniasis visceral, puede estar presente un nivel elevado de inmunoglobulina sérica con pico policlonal en la electroforesis de plasma sérico (SPEP). [ 1 ] La enfermedad visceral se diagnosticaba tradicionalmente basándose en la adición de formaldehído a una muestra de suero (prueba de aldehído), lo que aumentaría la viscosidad secundaria al exceso de inmunoglobulinas.
La electroforesis con acetato de celulosa es un método bien estandarizado para determinar las especies de parásitos cultivados a partir de muestras clínicas. Aunque esta prueba está estandarizada, requiere experiencia e instalaciones especiales; por lo tanto, solo está disponible en centros de diagnóstico altamente especializados.
Prueba cutánea de leishmanina (prueba de Montenegro)
En los Estados Unidos no se ha aprobado el uso de pruebas cutáneas para la leishmaniasis, principalmente debido a la falta de estandarización de estas pruebas. [ 1 ]
La prueba cutánea de leishmanina (LST), también conocida como prueba cutánea de Montenegro (por su introducción en Montenegro, Sudamérica), es similar al derivado proteico purificado (PPD) utilizado para la tuberculosis . Esta prueba se ha utilizado en el mundo en desarrollo para determinar reacciones de hipersensibilidad de tipo retardado.
Los promastigotes muertos se inyectan por vía intradérmica; un área de induración de 5 mm durante 48-72 horas sugiere una infección pasada (es decir, los resultados son negativos durante la leishmaniasis visceral activa; los resultados positivos se producen 2-3 meses después de la infección, generalmente después de una terapia exitosa. Los resultados de la prueba también son positivos en pacientes con leishmaniasis dérmica post-kala-azar).
Los dos principales inconvenientes de esta prueba son que no se pueden identificar infecciones agudas (en regiones endémicas, >70% de la población dará positivo), porque permanece positivo de por vida y quienes están inmunodeprimidos (pacientes inmunológicamente anérgicos) pueden no desarrollar una respuesta. Por lo tanto, esta prueba no se utiliza para distinguir entre enfermedad activa y resuelta, pero puede ser útil para evaluar poblaciones conocidas que no han sido expuestas y que se vuelven inmunológicamente sensibles a los antígenos de leishmania (es decir, con fines epidemiológicos).
Consideraciones sobre el enfoque
Cuándo tratar
Dada la morbilidad asociada, siempre se deben tratar las formas viscerales, mucocutáneas y graves de leishmaniasis cutánea. [ 28 ] Los pacientes deben recibir tratamiento en instalaciones con experiencia en el tratamiento de la enfermedad según las últimas pautas.
Debido a su potencial de progresar a leishmaniasis mucocutánea, se debe tratar definitivamente la leishmaniasis cutánea del Nuevo Mundo causada por miembros del subgénero Leishmania Viannia . Los casos debidos a L. tropica (Viejo Mundo) y algunas L. major de ciertas regiones de Afganistán pueden tener un curso más agresivo o crónico (hasta años); L. tropica ha sido implicada en casos ocasionales de leishmaniasis recidivante o viscerotrópica. Por lo tanto, puede ser necesario un tratamiento más exhaustivo en los casos causados por esta especie.
En la leishmaniasis del Nuevo Mundo, las estimaciones de recurrencia varían entre menos del 5% y hasta el 10% de los individuos no tratados que presentan úlceras crónicas, lesiones recidivantes o afectación mucocutánea. Debido a esto, el tratamiento es muy a menudo el estándar de atención y la terapia parenteral suele ser el tratamiento de elección.
La leishmaniasis cutánea del Nuevo Mundo debida a L. mexicana no está asociada con la leishmaniasis mucocutánea y puede no requerir tratamiento sistémico. La leishmaniasis cutánea adquirida en el Viejo Mundo tiende a resolverse espontáneamente (p. ej., L. mayor de Irak), pero los pacientes con esta infección deben recibir tratamiento si las lesiones son desfigurantes, dolorosas, infectadas, sobre las articulaciones o de curación lenta.
Gestión individualizada
Adapte el tratamiento a cada individuo, ya que la leishmaniasis es causada por muchas especies o subespecies de protozoos Leishmania , todas las cuales tienen diferentes grados de virulencia y predilecciones clínicas. [ 28 ] Considere el patrón clínico de la enfermedad, la región geográfica en la que ocurre la infección, el estado inmunológico del paciente y los intentos previos de tratamiento cuando se inicia la terapia.
Opciones de tratamiento
En general, si el caso no está avanzado con problemas gastrointestinales, hematológicos o infecciosos graves, la atención puede realizarse de forma ambulatoria. [ 28 ] Sin embargo, pueden requerirse visitas diarias a un médico para obtener medicación.
En todo el mundo se utilizan múltiples opciones de tratamiento médico para la enfermedad cutánea. Además de los medicamentos parenterales y orales (ver Medicación), las terapias locales para algunas formas de leishmaniasis cutánea incluyen (1) crioterapia, (2) infiltración de estibogluconato de sodio a 0,3-0,8 mL, (3) terapia de calor local a 40-42 °C y (4) varias preparaciones tópicas de paromomicina, generalmente al 15 % con urea al 10 %.
En el tratamiento de la leishmaniasis es de suma importancia el tratamiento de la desnutrición, de las enfermedades sistémicas concurrentes (p. ej., infección por el virus de la inmunodeficiencia humana [VIH], tuberculosis) o de las infecciones locales (bacterianas secundarias). Las personas desnutridas tienen mayor riesgo de contraer leishmaniasis, presentan mayor morbilidad y mortalidad en las enfermedades mucocutáneas y viscerales y responden peor al tratamiento que aquellas con una nutrición adecuada.
Otras cosas a considerar incluyen lo siguiente:
Al inicio del tratamiento, admita a los pacientes para realizarles análisis de laboratorio y monitorización cardíaca; los regímenes farmacológicos alternativos requieren niveles de monitorización variables acordes con sus efectos adversos conocidos.
Administrar terapia con antibióticos para tratar infecciones bacterianas superpuestas en las heridas y consultar a un especialista en enfermedades infecciosas o a un dermatólogo para obtener un diagnóstico y tratamiento definitivos.
Proporcionar cuidados de apoyo a pacientes con leishmaniasis visceral y mucocutánea grave, según sea necesario; el tratamiento de apoyo incluye descanso, una dieta rica en proteínas y calorías, transfusiones de sangre y cuidado de heridas.
El primer signo de mejoría es una mejoría de los síntomas; la regresión de la esplenomegalia tarda unos meses.
A pesar de los resultados clínicos exitosos, no está clara la cuestión de si los parásitos se erradican por completo, porque se ha informado de reactivación de la leishmaniasis con inmunosupresión. [ 29 ]
Inmunización
En algunas áreas del mundo (por ejemplo, Rusia, Oriente Medio), se han utilizado promastigotes vivos atenuados de L major de forma preventiva para inmunizar contra la leishmaniasis cutánea del Viejo Mundo. [ 28 ] Esta práctica produce una forma modificada de la enfermedad y da como resultado una cicatriz en el sitio de la inyección. La inmunidad a infecciones posteriores por L major suele ser buena; sin embargo, al igual que con la infección natural, no se produce inmunidad reactiva cruzada con otras especies de Leishmania .
Se están investigando muchas más formulaciones de vacunas contra la leishmania que sean de utilidad universal y cosméticamente aceptables . Hasta la fecha, no hay vacunas disponibles comercialmente.
Pautas de tratamiento
Resumen de las directrices Directrices para la prevención y el tratamiento de las infecciones oportunistas en adultos y adolescentes infectados por el VIH. Las recomendaciones de los CDC, los Institutos Nacionales de Salud y la Asociación de Medicina del VIH de la Sociedad de Enfermedades Infecciosas de Estados Unidos pueden ser de interés. [ 30 ] Las actualizaciones recientes de las directrices se pueden encontrar en el sitio web de AIDSinfo .
La Sociedad de Enfermedades Infecciosas de América está en proceso de desarrollar nuevas Guías de Práctica Clínica sobre Leishmaniasis .
En julio de 2022 se publicó la directriz de la OMS para el tratamiento de la leishmaniasis visceral en pacientes coinfectados por VIH en África Oriental y el Sudeste Asiático. Proporciona evidencia para la terapia combinada para el manejo de la leishmaniasis visceral con anfotericina B liposomal más miltefosina y también para la profilaxis secundaria después de un episodio inicial de LV. [ 1 , 28 ]
Farmacoterapia
Las terapias contra la leishmaniasis disponibles en los Estados Unidos son limitadas e incluyen las siguientes [ 3 , 28 ] :
Agentes antiparasitarios antimoniales pentavalentes
Anfotericina B liposomal
Miltefosina oral
Pentamidina
Otros agentes
Antibióticos
Agentes antiparasitarios antimoniales pentavalentes
Los pilares del tratamiento de la leishmaniasis son los compuestos de antimonio pentavalente introducidos por primera vez en la década de 1930. [ 28 ] Las dos preparaciones disponibles, el estibogluconato de sodio (Pentostam), producido en Gran Bretaña, y el antimoniato de meglumina (Glucantime), producido en Francia, tienen una eficacia similar. Según la especie y la región, se han reportado tasas de curación del 80-100% en general.
El estibogluconato de sodio solo está disponible en los CDC bajo un protocolo de fármaco nuevo en investigación (IND). El personal militar puede recibir estibogluconato de sodio en el Centro Médico Walter Reed del Ejército. Este agente se ha utilizado para el tratamiento de la leishmaniasis cutánea y mucocutánea en los Estados Unidos; también ha sido el fármaco de elección en el tratamiento de la leishmaniasis visceral, excepto en Europa y en regiones de la India con resistencia al estibogluconato.
En los Estados Unidos, a veces se controla a los pacientes hospitalizados cuando se administra antimonio pentavalente, pero es más aceptado el uso de centros de infusión que realizan evaluaciones completas antes del uso del fármaco. Es prudente realizar evaluaciones periódicas de la conducción cardíaca con monitoreo electroencefalográfico (ECG). Realice evaluaciones de laboratorio de hemogramas completos, función renal y niveles de amilasa, lipasa y transaminasas séricas.
El antimonio pentavalente debe utilizarse de acuerdo con el protocolo de los CDC. Si se considera una variación marcada del protocolo, se debe consultar a los expertos de los CDC.
Un estudio en Guatemala que incluyó una combinación de estibogluconato intravenoso (IV) y alopurinol mostró una eficacia mejorada contra las infecciones cutáneas por L. (Viannia) panamensis en comparación con el estibogluconato solo. [ 31 ] Sin embargo, este efecto no se reprodujo en el tratamiento de la leishmaniasis mucosa. En muchas regiones del mundo, la inyección intralesional directa de antimonio pentavalente se utiliza para tratar la enfermedad cutánea, aunque esto puede ser doloroso y es técnicamente difícil.
En un estudio posterior sobre estibogluconato de sodio intravenoso en personal militar estadounidense con leishmaniasis cutánea causada por L. (Viannia) panamensis , se validó la eficacia de un tratamiento de 10 días, con un perfil de efectos secundarios significativamente reducido en comparación con el tratamiento estándar de 20 días. [ 32 ] Sin embargo, los resultados pueden no ser aplicables a infecciones causadas por otras especies de Leishmania .
Lamentablemente, la resistencia a este agente está aumentando. En la provincia de Bihar, en la India, donde la leishmaniasis visceral es endémica, la resistencia alcanza el 43%.
Anfotericina B
La anfotericina B es eficaz contra la enfermedad mucocutánea resistente al antimonio pentavalente y la leishmaniasis visceral. Su uso es limitado debido a su perfil de efectos adversos tóxicos. Las preparaciones lipídicas más nuevas (complejo lipídico de anfotericina B, anfotericina B liposomal y dispersión coloidal de anfotericina B) son más activas, mejor toleradas y se están utilizando como terapia de primera línea contra la leishmaniasis visceral, pero la respuesta en la enfermedad cutánea ha sido desigual y el tratamiento es costoso.
La anfotericina B liposomal es el fármaco de elección para la leishmaniasis visceral debido a su evolución más corta y su menor toxicidad.
En un estudio comparativo abierto, Sundar et al. descubrieron que la eficacia de una única infusión de anfotericina B liposomal era equivalente a una infusión de anfotericina B convencional (15 infusiones en días alternos) para la leishmaniasis visceral. [ 33 ] Además, el grupo liposomal era menos costoso y presentaba menos efectos adversos relacionados con la infusión (p. ej., fiebre, escalofríos) en comparación con la anfotericina B convencional. [ 33 ]
Un estudio independiente realizado por Sundar et al. sugirió que diversas combinaciones de medicamentos, incluyendo anfotericina B liposomal, miltefosina y paromomicina (para duraciones tan cortas como 7 a 10 días), proporcionan regímenes efectivos, más seguros y más económicos en comparación con el régimen convencional de anfotericina B de 30 días para la leishmaniasis visceral. [ 34 ]
Un tratamiento de dosis única con anfotericina B liposomal ha demostrado una tasa de curación del 91% en la India. [ 35 ] En las áreas endémicas del norte de la India, la anfotericina liposomal se utiliza en combinación con miltefosina. [ 36 ] Un régimen de corta duración que consiste en una dosis única de anfotericina liposomal seguida de 7-14 días de miltefosina ha dado como resultado tasas de curación de más del 90%. [ 36 ] El régimen de anfotericina B liposomal de dosis única se ha vuelto asequible después de su inclusión en el Programa Kala-azar de la India, con la ayuda de donaciones de medicamentos facilitadas por la OMS.
La respuesta a la anfotericina B liposomal puede ser subóptima en pacientes infectados con el virus de la inmunodeficiencia humana (VIH). [ 37 ]
Miltefosina oral
El descubrimiento de una terapia asequible, administrada por vía oral y bien tolerada para la leishmaniasis visceral ha hecho realidad el tratamiento masivo de la enfermedad en el mundo en desarrollo. La miltefosina es el único agente oral que ha demostrado ser eficaz contra la leishmaniasis. Este fármaco es un análogo de la fosfocolina que se desarrolló originalmente como agente antineoplásico; interactúa con la síntesis de membrana y la producción de señales.
Los estudios de fase 2 y 3 del fármaco en la India mostraron que la miltefosina administrada por vía oral tenía una eficacia del 95-97% en la curación de pacientes con leishmaniasis visceral india. [ 38 ] El tratamiento oral de 2,5 mg/kg/día durante 4-6 semanas fue generalmente bien tolerado. Los efectos adversos comunes incluyeron malestar gastrointestinal y niveles elevados de creatinina, que se resolvieron con la interrupción del tratamiento.
Otro estudio sobre el tratamiento de la leishmaniasis visceral, que comparó la miltefosina oral con el desoxicolato de anfotericina B intravenoso, mostró una tasa de curación final después de 6 meses del 94% y el 97%, respectivamente. [ 39 , 40 ]
Un ensayo de fase IV de 2011 en Bangladesh encontró que la monoterapia con miltefosina oral (2,5 mg/kg/día) durante 28 días es eficaz en el tratamiento de la leishmaniasis visceral en niños y adultos. [ 41 ] Este medicamento está aprobado en la India para la leishmaniasis visceral.
En agosto de 2013, los Centros para el Control y la Prevención de Enfermedades (CDC) ampliaron el acceso al protocolo de nuevos fármacos en investigación (IND) vigente con la Administración de Alimentos y Medicamentos (FDA) para que la miltefosina esté disponible directamente desde los CDC para el tratamiento de las amebas de vida libre (FLA) en los Estados Unidos (por ejemplo, meningoencefalitis amebiana primaria [PAM] causada por Naegleria fowleri y encefalitis amebiana granulomatosa causada por las especies Balamuthia mandrillaris y Acanthamoeba . [ 42 ]
En marzo de 2014, la FDA aprobó la miltefosina oral para la leishmaniasis visceral debida a L. donovani ; la leishmaniasis cutánea debida a L. braziliensis, L. guyanensis y L. panamensis ; y la leishmaniasis mucosa debida a L. braziliensis . [ 3 , 39 ] La aprobación de la FDA fue para pacientes de 12 años o más, que pesen al menos 66 lb y que no estén embarazadas o amamantando. [ 3 ]
Pentamidina intramuscular
La pentamidina intramuscular es eficaz contra la leishmaniasis visceral, pero este fármaco se asocia con diabetes mellitus persistente y recurrencia de la enfermedad. La pentamidina es el fármaco de elección para tratar la L. (Viannia) guyanensis en la Guyana Francesa, donde prevalece la resistencia al antimonial. [ 43 ]
Otros agentes
Se han estudiado internacionalmente el ketoconazol, el itraconazol, el fluconazol, el alopurinol y la dapsona administrados por vía oral, pero ninguno es tan eficaz como los compuestos de antimonio pentavalente. Sin embargo, dado su perfil mínimo de efectos adversos, estos agentes pueden ser útiles para acelerar la curación en pacientes con leishmaniasis cutánea que no progresa a enfermedad mucosa y tiende a resolverse por sí sola.
Se ha demostrado que la dapsona es eficaz en la mayoría de los casos de leishmaniasis cutánea india después de seis semanas de tratamiento. [ 44 ]
El ketoconazol tiene una tasa de curación variable para la leishmaniasis cutánea del Nuevo Mundo, dependiendo de la especie. Un estudio mostró una tasa de curación del 89% para individuos infectados con L. mexicana en comparación con el 30% para L. (Viannia) braziliensis . [ 31 ] Se ha demostrado eficacia contra L. (Viannia) panamensis en Panamá y L. major en Irán e Israel, mientras que no se observó ningún efecto contra L. tropica en India y Turquía. [ 45 ]
Se informó que el fluconazol fue eficaz contra el 79% de los pacientes infectados con leishmaniasis cutánea no complicada causada por L major en Arabia Saudita. [ 46 ]
Antibióticos
Los pacientes con leishmaniasis pueden tener una enfermedad sistémica concurrente o una infección local. La leishmaniasis visceral es una infección oportunista importante asociada con el síndrome de inmunodeficiencia adquirida (SIDA), y los pacientes coinfectados con el virus de la inmunodeficiencia humana (VIH) pueden desarrollar manifestaciones inusuales de leishmaniasis. Se han establecido pautas para la prevención y el tratamiento de enfermedades oportunistas en pacientes con infección por VIH. [ 30 ]
La pentamidina es un medicamento de primera línea en la leishmaniasis cutánea, excepto en el caso de L. mexicana (ketoconazol 600 mg VO una vez al día durante 28 días). Es una alternativa de tratamiento en la leishmaniasis visceral. Las preparaciones antibióticas disponibles incluyen isetionato de pentamidina (Pentam) y dimetanosulfonato de pentamidina (Lomidine). El dimetanosulfonato de pentamidina administrado en la misma pauta de dosis es más eficaz que el isetionato de pentamidina.
Manejo de la leishmaniasis cutánea
El tratamiento de la leishmaniasis cutánea difiere según la etiología y la localización geográfica de la infección. [ 28 ] Para ciertos tipos de leishmaniasis cutánea en los que el potencial de propagación a las mucosas es bajo, se puede utilizar paromomicina tópica. Si solo hay una o unas pocas lesiones pequeñas (excluyendo la cara o sobre una articulación), puede ser adecuado un seguimiento cuidadoso sin tratamiento farmacológico.
Para lesiones más invasivas (por ejemplo, aquellas que no responden al tratamiento tópico; diseminación metastásica a los ganglios linfáticos; o lesiones cutáneas grandes, desfigurantes y múltiples, especialmente aquellas en la cara, cerca de superficies mucosas o cerca de articulaciones), se puede utilizar estibogluconato de sodio o pentamidina.
Miltefosina oral
El tratamiento de la leishmaniasis cutánea del Nuevo Mundo ha tenido distintos niveles de éxito. [ 2 , 28 ] En un ensayo controlado aleatorio de Brasil, la miltefosina utilizada sola fue significativamente mejor que el estibogluconato parenteral en niños mayores y adultos. [ 47 ] En Colombia, el tratamiento con miltefosina curó el 91% de las infecciones que involucraban a L. (Viannia) panamensis, de manera similar a la terapia con antimonio, mientras que curó solo el 53% de las infecciones que involucraban a L. (Viannia) braziliensis en Guatemala, muy por debajo de las tasas históricas de curación con antimonio.
Sin embargo, otro estudio en Bolivia mostró que la miltefosina oral administrada durante 28 días produjo una tasa de curación del 82% en comparación con el 88% del antimoniato de meglumina administrado por vía intramuscular contra L. (Viannia) braziliensis. [ 48 ] La tolerancia a la miltefosina oral fue tan superior al antimoniato de meglumina administrado por vía intramuscular que los investigadores no pudieron convencer a los médicos tratantes locales para que continuaran tratando al grupo de control con la terapia intramuscular.
Paromomicina tópica
Se ha demostrado que la paromomicina tópica es eficaz contra la leishmaniasis cutánea causada por L. major y L. mexicana . [ 28 ] Debido a que estas especies no tienden a causar enfermedad visceral o mucocutánea, la paromomicina tópica puede evitarle al paciente los efectos adversos sistémicos asociados con los medicamentos parenterales. La terapia tópica no se recomienda para el tratamiento de especies del Nuevo Mundo que se sabe que progresan a enfermedad mucocutánea.
En un estudio aleatorizado, doble ciego, controlado con grupos paralelos en 375 pacientes de una región de Túnez donde la leishmaniasis es endémica, Ben Salah et al. demostraron que la crema tópica de paromomicina, con o sin gentamicina, fue eficaz contra la leishmaniasis cutánea ulcerosa. [ 49 ] Los sujetos del estudio recibieron paromomicina al 15 %, paromomicina al 15 % más gentamicina al 0,5 %, o un control de vehículo (que no contenía ni gentamicina ni paromomicina). Después de 20 días de tratamiento, la paromomicina sola logró una tasa de curación del 82 %, la paromomicina-gentamicina logró una tasa de curación del 81 % y el control de vehículo logró una tasa de curación del 58 %. [ 49 ] Un ungüento que contiene paromomicina al 15 % y cloruro de metilbencetonio al 12 % mostró una tasa de curación incluso mayor del 87 % después de 20 días de tratamiento tópico para L major cutánea . [ 50 ] Desafortunadamente, el desempeño de esta crema con infecciones causadas por L. tropica ha sido decepcionante.
Aunque la paromomicina tópica no está disponible comercialmente en los Estados Unidos, esta crema puede estar disponible en farmacias y se utiliza en Israel para el tratamiento de lesiones L mayores .
Otros agentes y modalidades terapéuticas
Se informó que un tratamiento corto con pentamidina intramuscular durante cuatro días fue eficaz para la enfermedad cutánea en Colombia. [ 51 ] Un solo informe de Túnez encontró que la doxiciclina era eficaz en la leishmaniasis cutánea. [ 52 ]
Otros tratamientos reportados incluyen crema tópica de imiquimod, crioterapia, termoterapia, ketoconazol, terapia fotodinámica, itraconazol y alopurinol. Sin embargo, estos son efectivos solo cuando se usan en combinación con los medicamentos de primera línea.
Dado que las especies de Leishmania son sensibles a la temperatura, el tratamiento local con calor o frío ofrece una alternativa a la terapia farmacológica en algunos casos. La crioterapia se puede utilizar en lesiones pequeñas y sin complicaciones del Viejo Mundo. Un ciclo de congelación-descongelación-congelación de 15 a 20 segundos repetido según sea necesario durante 1-2 semanas fue suficiente para curar la mayoría de los casos de infecciones no complicadas por L. tropica y L. major .
En 2003, la FDA aprobó el dispositivo ThermoMed para el tratamiento de la leishmaniasis cutánea. Este dispositivo calienta la piel mediante ondas de radiofrecuencia dirigidas a una zona y profundidad específicas. Un estudio realizado en Afganistán sobre la enfermedad cutánea causada por L. tropica demostró una tasa de curación del 69% a los 100 días después del tratamiento. [ 53 ] Sin embargo, las lesiones tratadas en este estudio fueron pequeñas. Estudios posteriores pueden demostrar que se trata de una terapia útil para la enfermedad leve.
Manejo de la leishmaniasis mucocutánea
La enfermedad mucocutánea responde a un tratamiento de 20 días con gluconato de antimonio sódico; se puede utilizar anfotericina B para tratar casos avanzados o resistentes. También se ha recomendado el tratamiento con antimonio pentavalente durante 4 semanas. [ 28 ]
Un estudio de un solo brazo en adultos realizado para evaluar la eficacia de la miltefosina oral para el tratamiento de la leishmaniasis mucocutánea mostró que a los 12 meses de finalizada la terapia, el 62% de los pacientes presentaron resolución completa del edema, eritema, infiltración y erosión de las mucosas afectadas. [ 39 ] El estudio se realizó en Bolivia, donde L. braziliensis es epidemiológicamente la especie prevalente.
En este momento se desconoce el efecto protector contra la enfermedad mucocutánea posterior. Un estudio mostró una tasa de curación de un año del 75% entre los pacientes bolivianos que presentaron leishmaniasis mucocutánea leve. La cepa particular de L (Viannia) braziliensis afectó una zona conocida por su resistencia al antimonial. Las tasas de curación de un año fueron más bajas entre los pacientes con enfermedad más grave. Se requerirán estudios a largo plazo para determinar si se logró una curación definitiva.
Manejo de la leishmaniasis visceral
Esté alerta ante complicaciones relacionadas con la falla del sistema reticuloendotelial. [ 28 ] Los pacientes pueden presentar sangrado o neutropenia que lleve a condiciones infecciosas como neumonía o diarrea. Pueden ser necesarias transfusiones en caso de sangrado grave o anemia. Los antibióticos están indicados para tratar condiciones infecciosas intercurrentes.
En el subcontinente indio, se recomiendan los siguientes regímenes de tratamiento para la leishmaniasis visceral:
Anfotericina B liposomal sola, administrada en una dosis única (actualmente recomendada como el fármaco de elección por el programa de eliminación del kala azar de la India)
Anfotericina B liposomal en dosis única, en combinación con 7 días de miltefosina oral o 10 días de paromomicina
Miltefosina más paromomicina durante 10 días
Desoxicolato de anfotericina B: 0,75-1 mg/kg/día vía infusión, diariamente o en días alternos durante 15-20 dosis
Miltefosina por vía oral durante 28 días o paromomicina por vía intramuscular durante 28 días
Fuera de la India, el tratamiento con un compuesto antimonial pentavalente suele ser eficaz. Se debe considerar el uso de un agente parenteral alternativo incluso como terapia de primera línea en áreas donde prevalece la resistencia a la terapia con antimonio pentavalente, como sucede en la India, o si la terapia sin antimonio sería ventajosa por otras razones (por ejemplo, perfil de toxicidad, duración de la terapia).
La aparición de formulaciones liposomales de anfotericina B, que la dirigen pasivamente a los órganos ricos en macrófagos, ha sustituido en general a las formulaciones de desoxicolato. Como se ha señalado anteriormente, la anfotericina B liposomal es mucho más costosa que la anfotericina B convencional (lo que las hace prohibitivas en los países pobres), pero se asocian con una menor nefrotoxicidad y se pueden administrar en dosis considerablemente más cortas. Aunque la leishmaniasis visceral se trata tradicionalmente con múltiples dosis de desoxicolato de anfotericina B, parece, basándose en un único ensayo aleatorizado, que una única dosis de anfotericina B liposomal puede ser igual de eficaz y más barata. [ 33 ]
Otras alternativas parenterales que tienen mérito incluyen la anfotericina B (no sólo en forma de desoxicolato sino también en formas liposomales) y que en general han reemplazado a la pentamidina. También se ha informado que la paromomicina inyectable no es inferior a la anfotericina B.
La miltefosina oral está aprobada por la FDA para la leishmaniasis visceral, cutánea y mucocutánea. La sitamaquina es otra terapia oral en proceso de investigación para el tratamiento de la enfermedad visceral. Esta 8-aminoquinolina, descubierta originalmente por el Instituto de Investigación del Ejército Walter Reed, se encuentra actualmente en ensayos de fase 3 en Kenia y la India.
Leishmaniasis visceral resistente
La resistencia a los medicamentos puede ser primaria o secundaria. Las causas incluyen (1) diagnóstico tardío (duración prolongada de la enfermedad), (2) tratamiento interrumpido y de dosis baja, (3) falla inmunológica, (4) aparición de cepas resistentes de parásitos y (5) leishmaniasis asociada con el síndrome de inmunodeficiencia adquirida (SIDA).
Los pacientes con enfermedad resistente al estibogluconato deben ser tratados con agentes alternativos, como anfotericina liposomal (0,5-3 mg/kg) en días alternos hasta alcanzar una dosis de 20 mg/kg o pentamidina (2-4 mg/kg) en días alternos hasta alcanzar 15 dosis. La pentamidina está disponible en dos preparaciones: isetionato de pentamidina (Pentam 300) y dimetano sulfonato de pentamidina (Lomidine). Sin embargo, la eficacia de la pentamidina ha disminuido recientemente.
La anfotericina liposomal ha reportado tasas de curación de más del 90% en varios estudios. Sin embargo, el alto costo de este fármaco es una desventaja para su uso en áreas donde prevalece la leishmaniasis visceral.
Otro agente alternativo es la miltefosina oral. La miltefosina no impidió la recaída visceral en pacientes coinfectados con el virus de la inmunodeficiencia humana (VIH), pero siguió siendo eficaz con el retratamiento y durante períodos prolongados de terapia. [ 55 ]
El único modo de tratar y prevenir eficazmente la resistencia a los medicamentos parece ser el cambio de la monoterapia a combinaciones de múltiples fármacos en ciclos cortos administrados sin costo o a un costo asequible, mediante una terapia de observación directa. La terapia combinada de estibogluconato con fármacos como la aminosidina y el interferón gamma también ha producido buenos resultados en pacientes que no respondieron bien a la terapia con estibogluconato solo. La aminosidina, un aminoglucósido idéntico a la paromomicina, también ha demostrado ser eficaz en ensayos realizados en la India.
Se han establecido directrices para la prevención y el tratamiento de enfermedades oportunistas en pacientes con infección por VIH. [ 30 ] La leishmaniasis visceral es una infección oportunista importante asociada con el SIDA, y los pacientes coinfectados con VIH pueden desarrollar manifestaciones inusuales de leishmaniasis. Se están realizando investigaciones sobre nuevos sistemas de administración de fármacos para la anfotericina, incluido el uso de nanopartículas y cocleatos, pero estas investigaciones aún no han entrado en ensayos en humanos. [ 56 ]
Intervención quirúrgica
Por lo general, no se recomienda la escisión quirúrgica para tratar la leishmaniasis debido a los siguientes riesgos:
Recaída (exacerbación de una enfermedad inactiva)
Recurrencia en el sitio de escisión
Desfiguración cosmética
Puede ser necesaria una intervención quirúrgica para la esplenectomía complementaria en pacientes con enfermedad resistente al tratamiento. Los pacientes con leishmaniasis mucocutánea grave pueden requerir cirugía orofacial.
Monitoreo a largo plazo
Se debe vigilar cuidadosamente a los pacientes con leishmaniasis para detectar recaídas o recidivas hasta 6 meses después de un tratamiento exitoso.
Realizar una evaluación de seguimiento a los pacientes 6 semanas después de la última dosis de antimonio pentavalente. Están apareciendo cepas de leishmaniasis resistentes a los fármacos debido al uso no regulado de estos compuestos. La dosificación inadecuada y la duración acortada del tratamiento son factores contribuyentes. Se espera una mejoría de la enfermedad cutánea en las primeras dos semanas de tratamiento. Los pacientes con enfermedad visceral deben deshabituarse alrededor de las 72 horas, con resolución de la hepatoesplenomegalia a los 28 días.
La leishmaniasis recidivante grave, la leishmaniasis mucocutánea, la leishmaniasis cutánea difusa y la leishmaniasis post-kala azar suelen ser difíciles de tratar y pueden requerir una terapia prolongada.
Es posible que se requiera un nuevo tratamiento o medicamentos de segunda línea en pacientes con enfermedad resistente.
Prescribir hematínicos hasta que los niveles de hemoglobina del paciente regresen al rango de referencia.
Prevención
El diagnóstico y el tratamiento precoces son las principales medidas para controlar la leishmaniasis.
Inmunidad postinfección
Después de un tratamiento exitoso, los pacientes generalmente adquieren inmunidad (97-98% de eficacia) contra las especies de Leishmania con las que fueron infectados. Se cree que las infecciones abortivas debidas a la terapia con agentes efectivos reducen la inmunidad protectora que se observa a menudo en las infecciones de curso completo que se resuelven por sí solas.
Vacunación
En algunas zonas del mundo, a los niños se les inocula superficialmente material infectado en zonas ocultas para inducir la infección, promover la inmunidad y prevenir las cicatrices faciales.
Algunos estudios han demostrado que la vacunación con promastigotes de Leishmania muertos y bacilo de Calmette-Guérin (BCG) vivo protege contra la leishmaniasis cutánea. Sin embargo, no parece que esta vacuna proteja contra la leishmaniasis visceral.
Los intentos de crear una vacuna humana viable siguiendo líneas similares se han topado con dificultades y han dado lugar a lesiones cutáneas persistentes. En mayo de 2005, investigadores franceses del Centro de Investigación IRD Montpellier desarrollaron con éxito una nueva vacuna contra la leishmaniasis visceral en perros. [ 57 ] Utilizando proteínas antigénicas excretadas por el parásito en dosis de 100 y 200 mcg, el 100% de los perros (9 de 9) mostraron inmunidad durante un período de 2 años después de la infección con L. infantum .
La inmunidad parece estar relacionada con la activación de los linfocitos Th1, lo que permite a los macrófagos producir óxido nítrico y eliminar los parásitos de Leishmania . Los investigadores postulan que, al reducir la carga de la enfermedad en los perros, se puede interrumpir el ciclo de transmisión, lo que indirectamente reduce las infecciones humanas. Este nuevo enfoque se está evaluando actualmente para su incorporación en vacunas humanas.
Otras medidas
La erradicación de reservorios, el control de vectores y el tratamiento masivo de individuos infectados han tenido cierto éxito, pero están limitados por el costo y la dificultad de coordinar esfuerzos.
Los repelentes de insectos (por ejemplo, dietiltoluamida [DEET]), la ropa protectora, los ventiladores y los mosquiteros impregnados con permetrina o deltametrina ofrecen cierta protección a los visitantes de las zonas endémicas. La hembra de la mosca de la arena no hace ruido audible, vuela relativamente mal y es lo suficientemente pequeña como para atravesar los mosquiteros estándar; por lo tanto, se requieren mosquiteros especialmente diseñados de malla fina. También se debe minimizar la exposición al aire libre en las horas pico (desde el amanecer hasta el anochecer).
Debido a que la leishmaniasis puede transmitirse a través de la sangre, los pacientes infectados no deben donar sangre ni órganos.


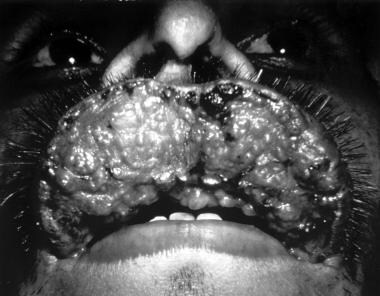
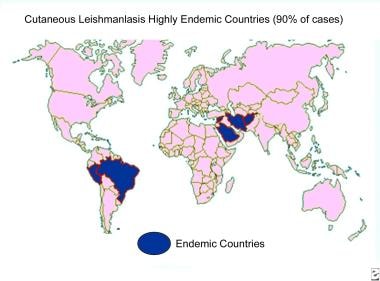
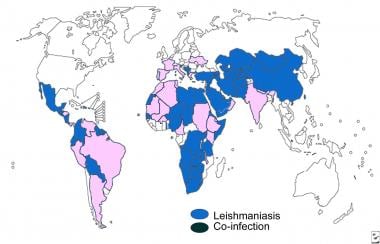
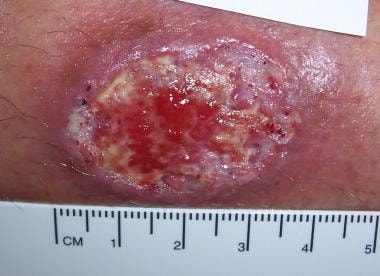
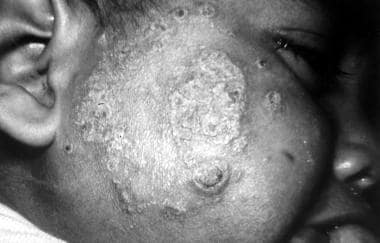
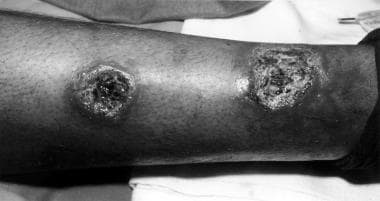
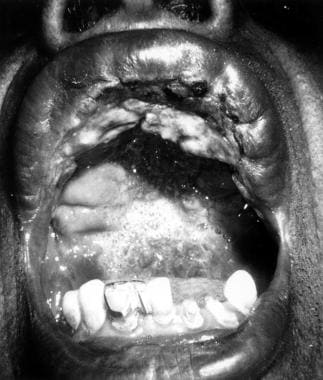
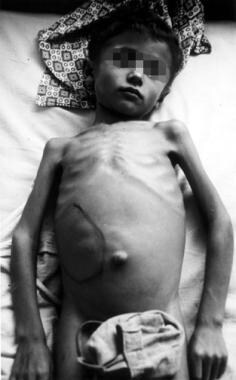
No hay comentarios:
Publicar un comentario