Anales de Pediatria Vol. 82. Núm. 1.Enero 2015
páginas e1-e192páginas 1-56
Introducción
La fiebre recurrente transmitida por garrapatas (FRTG) es una enfermedad zoonótica producida por espiroquetas del género Borrelia. Es endémica en diversas zonas de España, como Andalucía, Castilla-León y Extremadura. Presenta una incidencia menor a 0,2/100.000 habitantes/año1,2. En nuestro medio la enfermedad es causada por Borrelia hispanica. Se transmite al humano por la picadura de la garrapata blanda Ornithodoros erraticus3,4.
Se caracteriza por episodios recurrentes de fiebre elevada asociados a la espiroquetemia que se alternan con periodos de apirexia5. A pesar de ser emergente, es una enfermedad infradiagnosticada debido al bajo índice de sospecha y a la dificultad de su diagnóstico6,7.
El objetivo del estudio es presentar nuestra experiencia en el manejo diagnóstico y terapéutico de los pacientes pediátricos con FRTG y realizar una revisión de la literatura.
Pacientes y métodos
Análisis retrospectivo de historias clínicas de pacientes menores de 14años ingresados en nuestro Servicio de Pediatría con diagnóstico al alta de «fiebre recurrente transmitida por garrapatas» durante el periodo comprendido entre enero de 2002 y diciembre de 2012. Se analizan variables epidemiológicas, clínicas, pruebas de laboratorio y microbiológicas, tratamiento y resultado.
Resultado
Durante el periodo de estudio se identificaron 9 pacientes con FRTG (tabla 1). La mediana de edad fue de 11años (rango 3-13años). Todos los casos se produjeron durante meses cálidos (junio-octubre) en niños que vivían en medio rural y frecuentaban el campo. La clínica de presentación fue fiebre elevada y escalofríos en todos los casos. Se observó cefalea en el 67% de los pacientes, vómitos en el 67%, mialgias en el 56% y dolor abdominal en el 56%. Dos pacientes (22%) presentaron afectación meníngea caracterizada por cefalea intensa, fotofobia, vómitos y rigidez de nuca. En 2 casos se observó infección por Borreliaspp. en otros miembros de la familia. Se da la circunstancia de que en ambos se refería historia de excursión familiar al campo previa al inicio de la enfermedad. Seis pacientes (67%) presentaron recurrencias de la fiebre, oscilando el número entre uno y 4. La duración de cada episodio fue variable, siendo la media de 4días.
Tabla 1.
Características epidemiológicas, clínicas, de laboratorio, microbiológicas y tratamiento de los 9 casos de fiebre recurrente transmitida por garrapatas identificados durante el periodo de estudio
| N | Sexo | Edad (años) | Clínica | NR | Laboratorio | Visualización Borrelia en frotis s.p. | Tratamiento | Otros |
| 1 | V | 11 | Fiebre, cefalea, mialgias, escalofríos, artralgia, vómitos | 2 | PCR 68mg/l | Sí | Doxiciclina 8 días | Reacción Jarisch-Herxheiner |
| 2 | V | 12 | Fiebre, vómitos, dolor abdominal, tos, mareo | 0 | PCR 58mg/l, plaquetas 48×109/l | Sí | Doxiciclina 10 días | – |
| 3 | V | 5 | Fiebre, cefalea, mialgias, vómitos, dolor abdominal, rigidez de nuca | 0 | PCR 233mg/l, plaquetas 52×109/l, LCR 130 cel (80%l), creatinina 1,09mg/dl | Sí | Penicilina 14 días | Padre afectado. Madre afectada. Afectación meníngea |
| 4 | M | 8 | Fiebre, cefalea, escalofríos, dolor abdominal | 0 | PCR 331mg/l, plaquetas 46×109/l, leucocitos 3,5×109/l | Sí | Eritromicina 14 días | Madre afectada |
| 5 | M | 11 | Fiebre, vómitos | 4 | PCR 179mg/l, plaquetas 101×109/l | Sí | Doxiciclina 8 días | – |
| 6 | M | 13 | Fiebre, cefalea, mialgias, escalofríos, artralgia, dolor abdominal, lesión residual picadura | 1 | PCR 186mg/l | Sí | Doxiciclina 7 días | – |
| 7 | M | 5 | Fiebre, mialgias, hepatoesplenomegalia, lesión residual de picadura | 4 | PCR 140mg/l, VSG 86mm/h, plaquetas 140×109/l | No | Eritromicina 10 días | – |
| 8 | M | 3 | Fiebre, cefalea, mialgias, vómitos, dolor abdominal, esplenomegalia, rigidez de nuca | 4 | PCR 225mg/l, VSG 51mm/h, LCR 129 cel (93%l) | No | Eritromicina 14 días | Afectación meníngea |
| 9 | V | 12 | Fiebre, cefalea, vómitos, mareo | 2 | PCR 230mg/l, plaquetas 101×109/l | No | Doxiciclina 5 días | – |
cel: células; M: mujer; N: número de pacientes; NR: número de recurrencias; s.p.: sangre periférica; V: varón.
En las pruebas de laboratorio destacaba la elevación de la PCR en todos los casos, siendo la media de 187±84mg/l. Cinco pacientes mostraron trombocitopenia. Los 2 casos con afectación meníngea presentaron LCR con coloración clara, recuento celular bajo con células mononucleares y proteinorraquia y glucorraquia normales.
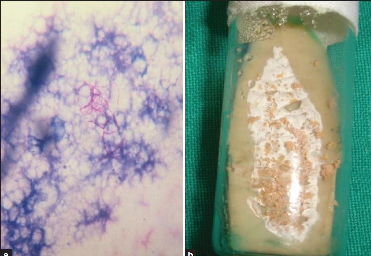
Se realizó el diagnóstico mediante visualización de Borreliaspp. en frotis de sangre periférica en 6 (67%) casos (fig. 1). Los otros 3 pacientes fueron diagnosticados en base a criterios clínicos, a la positividad a IgG Borrelia burgdoferi que presenta reacción cruzada con B.hispanica y a la adecuada respuesta al tratamiento. Se realizó tratamiento antibiótico en todos los pacientes, con una mediana de duración de 8días (rango 5-14días). Los antibióticos empleados fueron doxiciclina en 5 casos (todos ellos mayores de 8años), eritromicina en 3 y penicilina en uno. Se produjo reacción de Jarisch-Herxheiner en un único caso tratado con doxiciclina.
La mediana de estancia hospitalaria fue de 5días (rango de 2-12días). La evolución fue satisfactoria en todos los casos, sin secuelas.
Discusión
Presentamos una serie de 9 pacientes pediátricos con FRTG. Se trata de una patología emergente debido a la mejora de las técnicas moleculares que permiten identificar las especies causales de la enfermedad. A pesar de ello, pocas veces es diagnosticada en nuestro medio debido al bajo índice de sospecha existente y a la dificultad de su diagnóstico con las técnicas convencionales6,7.
Existen 2 variantes de fiebre recurrente: una forma epidémica transmitida por piojos (FRTP) y una forma endémica transmitida por garrapatas (FRTG)3. La FRTP es producida por Borrelia recurrentis y transmitida por el piojo Pediculus humanus. Es una forma más grave de enfermedad y se da principalmente en situaciones de pobreza, hacinamiento y catástrofes naturales8.
La FRTG tiene una distribución universal. En nuestro medio es posible encontrarla en áreas rurales y principalmente en meses cálidos. Se presenta como casos aislados o pequeños brotes9,10. Las especies responsables son B.hispanica y una nueva especie de Borrelia identificada en 19961,3,4. También han sido descritos en España casos importados producidos por otras especies de Borrelia procedentes de áreas de alta incidencia11.
Los síntomas de la enfermedad aparecen de forma abrupta tras un periodo de incubación que oscila de 3 a 18días. Durante el periodo febril una elevada carga de espiroquetas circula en sangre, mientras que en los periodos afebriles quedan confinadas en diversos órganos, especialmente en el SNC. El episodio febril cede tras la producción de anticuerpos específicos frente a una proteína variable de membrana de Borrelia. Los sucesivos episodios febriles se producen como consecuencia de la aparición de nuevas variantes antigénicas que confieren a la espiroqueta capacidad para evadir el sistema inmune12,13.
Las manifestaciones clínicas se caracterizan por episodios de fiebre elevada que duran de 3 a 6días. Se continúan con un periodo de apirexia que oscila de 4 a 14días antes de la siguiente recidiva. Los síntomas acompañantes son inespecíficos: escalofríos, cefaleas, mialgias, artralgias, vómitos y dolor abdominal. Puede cursar además con exantema, tos seca o hepatoesplenomegalia1,2. Como complicaciones puede presentar meningitis, meningoencefalitis, convulsiones, parálisis de pares craneales, hemiplejía, coma, iritis, distrés respiratorio severo, fracaso hepático, miocarditis e incluso la muerte12,14 En los sucesivos episodios febriles los síntomas disminuyen en intensidad. El número medio de recaídas es de 3, aunque se han descrito casos con 131. Los hallazgos analíticos son inespecíficos: anemia, leucopenia, trombocitopenia, elevación de reactantes de fase aguda, alteración de la bioquímica hepática y/o renal. En los casos con afección neurológica se identifica en LCR color claro, aumento de presión, pleocitosis a expensas de células mononucleares, discreta elevación de proteínas y glucorraquia normal1,2.
El diagnóstico se realiza principalmente mediante la observación directa de espiroquetas en sangre periférica con tinciones de Wright o Giemsa. En el proceso febril puede identificarse la espiroqueta hasta en el 70% de los casos1,2. La serología tiene poca utilidad por los cambios antigénicos que las espiroquetas experimentan en las recurrencias de la enfermedad, pero existe reactividad cruzada con IgG de B.burgdoferi15. La identificación a través de PCR en muestras de sangre presenta una elevada sensibilidad y especificidad, permitiendo un diagnóstico rápido de la enfermedad, así como de la especie responsable16.
La FRTG debe diferenciarse de la enfermedad de Lyme causada por B.burgdoferi. Esta presenta eritema migratorio en una primera fase, pudiendo seguirse de meningitis con neuropatía craneal y/o periférica y bloqueo auriculoventricular en una segunda fase de infección diseminada. Por último, en una tercera fase de infección tardía puede presentar artritis, acrodermatitis crónica atrófica o afectación neurológica crónica17,18. También ha de establecerse el diagnóstico diferencial con la malaria en el caso de pacientes procedentes de áreas endémicas, brucelosis, fiebre tifoidea, meningococemia crónica, yersiniosis, infecciones víricas (VHS, parvovirus, enterovirus), inmunodeficiencias, enfermedades inflamatorias y procesos oncohematológicos2,19.
El tratamiento más adecuado es doxiciclina 5-10días. En menores de 8años puede utilizarse eritromicina, aunque se han descrito fracasos con macrólidos. Otras posibilidades son penicilina o cefalosporinas de tercera generación. En caso de meningitis se recomienda penicilina, cefotaxima o ceftriaxona intravenosa al menos 14días1,2. Se ha descrito reacción de Jarisch-Herxheimer hasta en el 54% de los casos. Suele producirse en las 3 primeras horas tras la administración del antibiótico. Generalmente es leve y autolimitada pero existe un 5% de casos graves, por lo que se recomienda la observación del paciente durante las primeras horas tras iniciar el tratamiento20.
El pronóstico de la enfermedad es bueno, siendo la mortalidad inferior al 1% en caso de tratamiento adecuado1,2.
Como medidas de prevención se recomienda evitar zonas con riesgo de garrapatas infectadas, uso de repelentes, empleo de ropa adecuada y examen corporal para eliminar las garrapatas adheridas. No existe suficiente evidencia para recomendar tratamiento antibiótico profiláctico tras la picadura de garrapata1.
Subrayamos la importancia de mantener un elevado índice de sospecha de FRTG en regiones endémicas ante cuadros febriles recurrentes con PCR elevada. El diagnóstico precoz mediante la observación directa de espiroquetas en sangre periférica, junto con el adecuado tratamiento antibiótico, permite evitar la aparición de recurrencias febriles y potenciales complicaciones.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.